题目内容
7.能在水溶液中大量共存的一组离子是( )| A. | H+、Fe3+、I-、SO42- | B. | Al3+、Mg2+、HCO3-、Cl- | ||
| C. | K+、Ca2+、NO3-、SiO32- | D. | K+、Na+、OH-、AlO2- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、不能相互促进水解反应等,则离子大量共存,以此来解答.
解答 解:A.Fe3+、I-发生氧化还原反应,不能大量共存,故A不选;
B.Al3+、Mg2+分别于HCO3-相互促进水解生成沉淀,不能大量共存,故B不选;
C.Ca2+、SiO32-结合生成沉淀,不能大量共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重氧化还原反应、水解反应及复分解反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
17.现有X、Y、Z、M四种短周期元素,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法不正确的是( )
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| C. | 气态氢化物的稳定性:Z<M | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
18.666℃和1.01×105 Pa时,反应“CaCO3(s)═CaO(s)+CO2(g)△H=+178.3kJ/mol”能自发进行的原因是( )
| A. | 温度升高 | B. | 该反应熵增 | ||
| C. | 熵增效应大于能量效应 | D. | 反应速率加快 |
15.W、R、X、Y、Z是五种短周期元素,部分信息如表所示:
请回答下列问题:
(1)Z的元素符号可能是H、Be、Al;
(2)XW3能使红色湿润石蕊试纸变蓝色;
(3)Y和R元素组成常见的化合物的化学式为CO2或SiO2;
(4)画出Y的简单离子结构示意图: .
.
| 元素代号 | 部分信息 |
| W | W是一种核素没有中子 |
| R | R原子的最外层电子数等于K层电子数的2倍 |
| X | X原子得到3个电子达到稳定结构,单质在常温、常压下呈气态 |
| Y | Y原子的最外层电子数是电子层数的3倍 |
| Z | Z原子的电子层数等于最外层电子数 |
(1)Z的元素符号可能是H、Be、Al;
(2)XW3能使红色湿润石蕊试纸变蓝色;
(3)Y和R元素组成常见的化合物的化学式为CO2或SiO2;
(4)画出Y的简单离子结构示意图:
 .
.
2.已知,将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 ,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关,当n(KOH)=a mol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{{O}_{3}}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量小于$\frac{1}{2}$a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$a mol |
12.下列说法不正确的是( )
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | 为除去溴苯中的溴,可用NaOH溶液洗涤,再分液 | |
| C. | 为除去乙炔气中少量的H2S,可使其通过CuSO4 溶液 | |
| D. | 为除去CO2 中少量的SO2 ,可使其通过饱和Na2CO3溶液 |
15.化学与生活密切相关,下列说法正确的是( )
| A. | 绿色食品是只指纯天然食品,不含任何化学物质 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI | |
| D. | 只要带专用口罩,就不怕雾霾天气对人体产生伤害 |
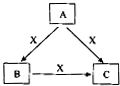 A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答: