题目内容
17.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面.工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2.
完成下列填空
(1)第①步反应的化学方程式为2NH4Cl+Ca(OH)2=2NH3•H2O+CaCl2.
第②步反应的化学方程式为CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl.
(2)可循环使用的物质是NH4Cl.
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为H2O2价格较高且易分解,碱性条件下抑制CaO2•8H2O溶解.
(3)检验CaO2•8H2O是否洗净的方法是取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净.
(4)CaO2•8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,
目的是防止过氧化钙和水反应、防止过氧化钙分解.
(5)已知CaO2在350℃迅速分解生成CaO和O2.如图是实验室测定产品中CaO2含量的装置(夹持装置省略).
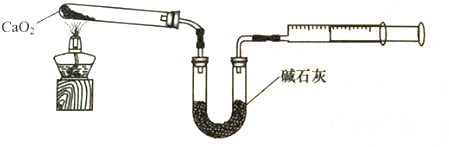
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为$\frac{9V}{14m}$%(用字母表示).
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量.
分析 (1)第①步中氯化铵和氢氧化钙发生复分解反应生成一水合氨和氯化钙;
第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵;
H2O2价格较高且易分解;
(3)实验室用硝酸酸化的硝酸银溶液检验;
(4)CaO2能和水反应,氧气能抑制CaO2分解;
(5)根据过氧化钙和氧气之间的关系式计算;
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量.
解答 解:(1)第①步中氯化铵和氢氧化钙发生复分解反应生成一水合氨和氯化钙,反应方程式为2NH4Cl+Ca(OH)2=2NH3•H2O+CaCl2;
第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵,反应方程式为CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
故答案为:2NH4Cl+Ca(OH)2=2NH3•H2O+CaCl2;CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵,所以可以循环使用的物质是NH4Cl;
H2O2价格较高且易分解,碱性条件下抑制CaO2•8H2O溶解,所以工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产;
故答案为:NH4Cl;H2O2价格较高且易分解,碱性条件下抑制CaO2•8H2O溶解;
(3)实验室用硝酸酸化的硝酸银溶液检验,如果沉淀没有洗涤干净,向洗涤液中加入硝酸酸化的硝酸银溶液应该有白色沉淀,其检验方法是:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净,
故答案为:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净;
(4)CaO2能和水反应生成氢氧化钙和氧气,CaO2在350℃迅速分解生成CaO和O2,所以通入氧气能抑制超氧化钙分解;
故答案为:防止过氧化钙和水反应、防止过氧化钙分解;
(5)设超氧化钙质量为x,
2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑
144g 22.4L
x 10-3VL
144g:22.4L=x:10-3VL
x=$\frac{144g×1{0}^{-3}VL}{22.4L}$=$\frac{144V}{22400}$g=$\frac{9V}{1400}g$,
其质量分数=$\frac{\frac{9V}{1400}g}{mg}×100%$=$\frac{9V}{14m}$%,
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量,
样品质量和反应后固体质量,
故答案为:$\frac{9V}{14m}$%;样品质量和反应后固体质量.
点评 本题考查制备实验方案评价,为高频考点,侧重考查离子检验、化学反应方程式的书写、物质含量测定等知识点,明确实验原理及物质性质是解本题关键,难点是题给信息的挖掘和运用.

 金钥匙试卷系列答案
金钥匙试卷系列答案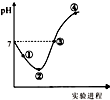 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | 曲线起点处水的电离程度最大,可用pH试纸测定溶液pH | |
| B. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| C. | 氯气~氯水体系中:c(H+)=c(Cl2)+c(HClO)+c(ClO-) | |
| D. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
| A. | Cu和Fe相连插入某溶液中形成原电池,则Fe一定作负极 | |
| B. | MgCl2中混有少量的FeCl3,可以通过溶解,加入过量MgO、过滤、结晶等操作进行提纯 | |
| C. | 用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明阴极只有Cu2+被还原 | |
| D. | 将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,最后可能只有Fe剩余 |
| A. | 乙醇 | B. | 乙酸 | C. | 甲醇 | D. | 乙醛 |