题目内容
5.下列说法中正确的是( )| A. | Cu和Fe相连插入某溶液中形成原电池,则Fe一定作负极 | |
| B. | MgCl2中混有少量的FeCl3,可以通过溶解,加入过量MgO、过滤、结晶等操作进行提纯 | |
| C. | 用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明阴极只有Cu2+被还原 | |
| D. | 将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,最后可能只有Fe剩余 |
分析 A、Cu和Fe相连插入某溶液中形成原电池,如果电解质是浓硫酸,因为铁在浓硫酸中发生钝化,所以铜作负极;
B、MgCl2+2H2O?Mg(OH)2+2HCl;FeCl3+3H2O?Fe(OH)3+3HCl(水解),MgO吸收H+,生成MgCl2,溶液酸性减弱,由于FeCl3在PH=3-4,便开始水解,在PH=4几乎水解完全,即除去FeCl3;
C、用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明溶质和溶剂都放电;
D、将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,铜离子的氧化性强,所以铁首先与铜离子发生氧化还原反应,生成单质铜,所以剩余固体中一定有铜.
解答 解:A、Cu和Fe相连插入某溶液中形成原电池,如果电解质是浓硫酸,因为铁在浓硫酸中发生钝化,所以铜作负极,随反应的进行,浓硫酸变稀硫酸,铁作负极,故A错误;
B、MgCl2+2H2O?Mg(OH)2+2HCl;FeCl3+3H2O?Fe(OH)3+3HCl(水解),MgO吸收H+,生成MgCl2,溶液酸性减弱,由于FeCl3在PH=3-4,便开始水解,在PH=4几乎水解完全,即除去FeCl3,故B正确;
C、用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明溶质和溶剂都放电,所以阴极还有H+被还原,故C错误;
D、将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,铜离子的氧化性强,所以铁首先与铜离子发生氧化还原反应,生成单质铜,所以剩余固体中一定有铜,故D错误;
故选B.
点评 本题考查电化学的反应原理以及通过平衡的移动来分析除杂的相关知识,有一定的难度,特别是B选项中的除杂问题.

练习册系列答案
相关题目
18.一些烷烃的燃烧热如表:
下列表达正确的是( )
| 化合物 | 燃烧热/kJ•mol-1 | 化合物 | 燃烧热/kJ•mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 异戊烷 | 3531.3 |
| A. | 正戊烷的燃烧热小于3531.3kJ•mol-1 | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);△H=-1560.8 kJ | |
| D. | 相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多 |
16.在一定条件下,X与强酸、强碱溶液反应如下.则下列说法正确的是( )
Y$\underset{\stackrel{强酸}{←}}{\;}$X$\stackrel{强碱}{→}$Z.
Y$\underset{\stackrel{强酸}{←}}{\;}$X$\stackrel{强碱}{→}$Z.
| A. | 若X为单质铝,则Y的气体产物只能是氢气 | |
| B. | 若X为NaHCO3,则Z一定有CO2 | |
| C. | 若Y、Z为含铝元素的两种盐,则X一定为Al(OH)3 | |
| D. | 若X为乙酸乙酯,则生成物Y、Z中均含有乙醇 |
20.甲醇、乙二醇、丙三醇分别同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,则消耗这三种醇的物质的量之比为( )
| A. | 3:2:1 | B. | 1:2:3 | C. | 2:3:6 | D. | 6:3:2 |

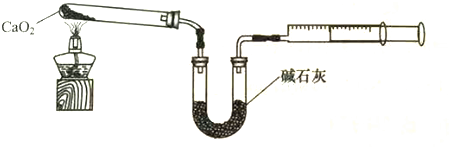
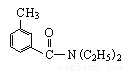 ;DEET在一定条件下,可通过下面的路线来合成:
;DEET在一定条件下,可通过下面的路线来合成: