题目内容
向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO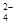 的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
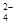 的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )| A.当消耗13克Zn时, 得到的还原产物为0.25mol |
| B.当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ |
| C.反应中最多有两种单质生成 |
| D.反应结束时,可得到0.25molZnSO4 |
A
三种阳离子的氧化性大小顺序是Fe3+、Cu2+、H+,所以首先还原的是Fe3+、然后是Cu2+,最后是H+。13g锌是0.2mol,失去0.4mol电子,所以根据电子的得失守恒可知,还原产物应该是0.1mol亚铁离子、0.1mo铜和0.05mol氢气,所以A正确,B不正确,含有亚铁离子;C不正确,锌足量还能生成单质铁,D不正确,应该是0.30mol硫酸锌,答案选A。

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目


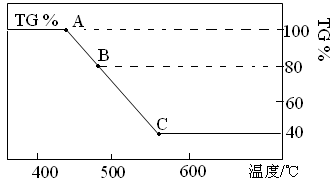
 Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。