题目内容
(14分)某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。

请回答:
(1)由I可知X中一定存在的是 ,步骤I所发生反应的离子方程式为: 、 。
(2)反应II的化学方程式是 。
为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。

(3)由Ⅲ可得出的结论为: 。
(4)步骤Ⅳ所得蓝色溶液中阳离子为 。
(5)原混合物中各成分的质量之比是 。(不必化简)

请回答:
(1)由I可知X中一定存在的是 ,步骤I所发生反应的离子方程式为: 、 。
(2)反应II的化学方程式是 。
为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。

(3)由Ⅲ可得出的结论为: 。
(4)步骤Ⅳ所得蓝色溶液中阳离子为 。
(5)原混合物中各成分的质量之比是 。(不必化简)
(1)Fe2O3、Cu Fe2O3+6H+===2Fe3++3H2O Cu+2Fe3+===2Fe2++Cu2+
(2)SiO2+2NaOH===Na2SiO3+H2O (3)混合物X中无A12O3
(4)H+ Cu2+ Fe2+(5)m(Fe2O3):m(Cu) :m(SiO2) ="3.2" :3.2 :3.0
(2)SiO2+2NaOH===Na2SiO3+H2O (3)混合物X中无A12O3
(4)H+ Cu2+ Fe2+(5)m(Fe2O3):m(Cu) :m(SiO2) ="3.2" :3.2 :3.0
(1)和过量的盐酸反应所得溶液显蓝色,说明有铜离子生成。由于单质铜和盐酸是不反应的,所以必须含有氧化铁,氧化铁和盐酸反应生成的铁离子能氧化单质铜,因此X中一定存在的是Fe2O3、Cu,步骤I所发生反应的离子方程式为Fe2O3+6H+===2Fe3++3H2O、 Cu+2Fe3+===2Fe2++Cu2+。
(2)由于剩余的固体和氢氧化钠反应后,仍然有固体剩余,这说明4.92g固体中一定含有二氧化硅,和氢氧化钠溶液的方程式是SiO2+2NaOH===Na2SiO3+H2O。
(3)根据(2)可知二氧化硅的质量是4.92g-1.92g=3.00g。而在反应Ⅲ中,固体减少的质量恰好是3.00g,所以混合物X中无A12O3。
(4)同样根据(2)可知,剩余铜是1.92g,所以步骤Ⅳ所得蓝色溶液中阳离子为H+ Cu2+ Fe2+。
(5)根据方程式Fe2O3+6H+===2Fe3++3H2O、Cu+2Fe3+===2Fe2++Cu2+可知,Fe2O3~Cu,因此氧化铁的物质的量是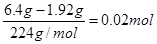 ,质量是3.2g,则铜的质量是6.4g-3.2g=3.2g,则原混合物中各成分的质量之比是m(Fe2O3):m(Cu) :m(SiO2) ="3.2" :3.2 :3.0。
,质量是3.2g,则铜的质量是6.4g-3.2g=3.2g,则原混合物中各成分的质量之比是m(Fe2O3):m(Cu) :m(SiO2) ="3.2" :3.2 :3.0。
(2)由于剩余的固体和氢氧化钠反应后,仍然有固体剩余,这说明4.92g固体中一定含有二氧化硅,和氢氧化钠溶液的方程式是SiO2+2NaOH===Na2SiO3+H2O。
(3)根据(2)可知二氧化硅的质量是4.92g-1.92g=3.00g。而在反应Ⅲ中,固体减少的质量恰好是3.00g,所以混合物X中无A12O3。
(4)同样根据(2)可知,剩余铜是1.92g,所以步骤Ⅳ所得蓝色溶液中阳离子为H+ Cu2+ Fe2+。
(5)根据方程式Fe2O3+6H+===2Fe3++3H2O、Cu+2Fe3+===2Fe2++Cu2+可知,Fe2O3~Cu,因此氧化铁的物质的量是
 ,质量是3.2g,则铜的质量是6.4g-3.2g=3.2g,则原混合物中各成分的质量之比是m(Fe2O3):m(Cu) :m(SiO2) ="3.2" :3.2 :3.0。
,质量是3.2g,则铜的质量是6.4g-3.2g=3.2g,则原混合物中各成分的质量之比是m(Fe2O3):m(Cu) :m(SiO2) ="3.2" :3.2 :3.0。
练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
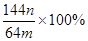 。该学生的计算是否正确: ,请说明理由 。
。该学生的计算是否正确: ,请说明理由 。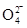 )。
)。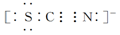
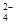 的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )