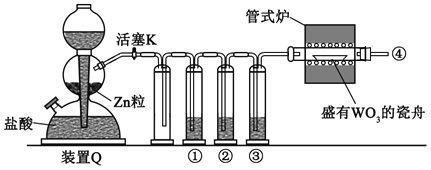
题目内容
【题目】镍及其化合物在工农业生产中有着广泛应用,回答下列问题:
(1)基态镍原子的价电子排布式为________________;元素镍的第二电离能比铜小,其原因为__________________________________________________。
(2)Ni2+的检验可通过如下反应进行:

①二肟中碳原子的杂化轨道类型为__________。
②二丁二肟合镍(II)中存在的作用力有____________(填选项字母)。
a.σ键 b.π键 c.配位键 d.氢键
(3)Ni(CO)4可通过如下反应合成:NiS+5CO+4OH-→Ni(CO)4+S2-+CO32-+2H2O。反应中涉及所有元素的电负性由大到小的顺序为__________;与CO32-互为等电子体的分子有__________(任写2种)。
(4)Ni与As组成的某种化合物的晶体结构如图所示。

①每个Ni原子周围相邻的As原子有__________个。
②该化合物的化学式为__________,晶体密度为__________g·cm-3(列出计算式即可)。
【答案】3d84s2 铜原子失去第二个电子是全满的3d10电子,处于稳定状态第二电离能较大,镍原子失去的第二个电子是4s1,处于半满状态,第二电离能较低 sp2、sp3 abcd O>S>C>H>Ni BF3、SO3 6 NiAs 
【解析】
(1)基态镍原子为28号元素根据构造理论书写核外电子排布,镍元素失去第二个电子最外层为4s1,铜失去第二个电子是3d10;
(2)①丁二肟中碳原子键连方式为碳氮双键和甲基中的碳氢单键;
②二丁二肟合镍(II)中含有配位键、共价单键、氢键和碳氮双键;
(3)反应中涉及所有元素有H、C、O、S、Ni,元素非金属性越强,电负性越强;等电子体是指价电子数和原子数相同的分子、离子或基团;
(4)①根据图示判断每个Ni原子周围相邻的As原子的个数;
②根据均摊法计算化合物化学式,根据晶胞密度计算公式ρ=![]() 计算。
计算。
(1)Ni元素原子核外有28个电子,基态镍原子核外电子排布为1s22s22p63s23p63d84s2或[Ar]3d84s2,价电子排布式为3d84s2;基态铜原子核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,元素镍的第二电离能比铜小,其原因是铜原子失去第二个电子是全满的3d10电子,处于稳定状态第二电离能较大,镍原子失去的第二个电子是4s1,处于半满状态,第二电离能较低;
(2)①丁二肟中含有甲基,碳原子全部是单键,该碳原子为sp3杂化,含有碳氮双键,为平面结构,碳原子为sp2杂化;
②二丁二肟合镍(II)中含有共价键、氢键,共价单键都是σ键,碳氮双键中含有一个σ键和一个π键,氮原子与镍原子以配位键相连,则二丁二肟合镍存在的作用力有abcd;
(3)反应中涉及所有元素有H、C、O、S、Ni,元素非金属性越强,电负性越强,涉及所有元素的电负性由大到小的顺序为:O>S>C>H>Ni;等电子体是指价电子数和原子数相同的分子、离子或基团,CO32-的原子数为4,价电子数为24,与CO32-互为等电子体的分子有BF3、SO3;
(4)①有图可知,每个Ni原子周围相邻的As原子有6个;
②根据均摊法,Ni原子位于晶胞的顶点、上下面心,体心和棱上,数目为12×![]() +2×
+2×![]() +1+6×
+1+6×![]() =6个,As原子位于晶胞的体内,共有6个,则该化合物的化学式为NiAs;如图所示,六棱柱的体积为6个三棱柱的体积,每个三棱柱的体积=
=6个,As原子位于晶胞的体内,共有6个,则该化合物的化学式为NiAs;如图所示,六棱柱的体积为6个三棱柱的体积,每个三棱柱的体积=![]() ×
×![]() a2b,则六棱柱的体积为6×
a2b,则六棱柱的体积为6×![]() a2b=
a2b=![]() a2b×10-30cm3,根据晶胞密度计算公式ρ=
a2b×10-30cm3,根据晶胞密度计算公式ρ=![]() =
= =
= g·cm-3。
g·cm-3。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。 回答下列问题:
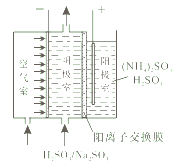
(1)阴阳极同步产生过氧化氢和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极发生氧化反应的离子是_______,阴极的电极反应式为_________。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% | |
无 | — | 2 | Fe3+ | 1.0 | 15 | |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 | |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为________(填标号)。
A 纯铝 B 黄铜 C 铸铁 D 不锈钢
(3)在弱碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=OH(aq)+Mn3+(aq)+OH-(aq) ΔH=a kJ/mol
H2O2(aq)+Mn3+(aq)+2OH-(aq)=Mn2+(aq)+·O2- (aq)+2H2O(l) Δ=b kJ/mol
OH(aq)+·O2-(aq)=O2(g)+OH-(aq) ΔH=c kJ/mol
则2H2O2(aq)=2H2O(l)+O2(g)的ΔH=_________,该反应的催化剂为________。
(4)298 K时,将10 mL a mol·L1 NaH2PO2、10 mL 2a mol·L1 H2O2溶液和10 mL NaOH溶液混合,发生反应:H2PO2-(aq)+2H2O2(aq)+2OH(aq)![]() PO43-(aq)+4H2O(l)。溶液中c(PO43-)与反应时间(t)的关系如图所示。
PO43-(aq)+4H2O(l)。溶液中c(PO43-)与反应时间(t)的关系如图所示。
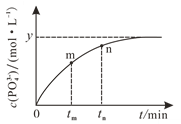
①下列可判断反应达到平衡的是_______(填标号)。
a c(H2PO2-)=y mol·L1
b 溶液的pH不再变化
c v(H2O2)=2v(H2PO2-)
d c(PO43-)/c(H2PO2-)不再变化
②tm时v逆_____tn时v逆(填“大于”“小于”或“等于”)。
③若平衡时溶液的pH=12,则该反应的平衡常数K为___________。
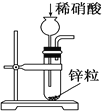
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D