题目内容
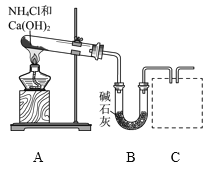
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。

(1)该温度下,该反应的平衡常数为______________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是____________________________________________________。
【答案】 0.9 bd 0.04 mol·L-1·min-1 0.8 mol NO2 小于 假设平衡时二氧化氮的浓度为0.8 mol·L-1,则此时Qc=1.28>K=0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1
【解析】(1)由图可知,在前10min内,两种物质的变化量分别为0.2mol/L和0.4mol/L,所以,在平衡状态下,N2O4和NO2的物质的量浓度分别为0.4mol/L和0.6mol/L,该温度下,该反应的平衡常数为![]() 。
。
(2)a、b、c、d四个点中,b、d点对应的各组分的物质的量浓度保持不变,所以,表示化学反应处于平衡状态的是b、d点。从起点开始首次达到平衡时,用时10min,的物质的量浓度的变化量是0.4 mol·L-1,所以以NO2表示的反应速率为0.04 mol·L-1·min-1。
(3)从25 min 后两种物质的变化趋势及变化量进行分析可知,25 min时,NO2的浓度由0.6mol/L增加到1.0mol/L,增加了0.4 mol·L-1,所以加入了0.8 mol NO2,使平衡发生了移动。
(4)d点对应NO2的物质的量浓度小于0.8 mol·L-1,理由是:假设平衡时二氧化氮的浓度为0.8 mol·L-1,则此时四氧化二氮的浓度为0.5 mol·L-1,Qc=![]() 1.28>K=0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1。
1.28>K=0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1。

【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D