��Ŀ����
����Ŀ����֪��A��B��C��D���ֶ�����Ԫ�أ�A��Dԭ������֮�͵���B��C��ԭ������֮�ͣ���DԪ����ɵĵ�����ͨ��״���³ʻ���ɫ��B��C��D����Ԫ��λ��ͬһ���ڣ�A��B��C����Ԫ�ص�����������Ӧ��ˮ����ֱ�ΪX��Y��Z���Ҵ�������ת����ϵ����֪Z�dz�������������������ƶϻش��������⣮ 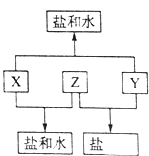
��1��DԪ��ԭ�ӵĽṹʾ��ͼΪ��
��2��A��B��C����Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ����Ԫ�ط��ű�ʾ����
��3��Y��CԪ�ص������������Է�����Ӧ���÷�Ӧ�����ӷ���ʽΪ��
��4��ʵ�����У�Ӧ��X��Ũ��Һ��������ɫ�Լ�ƿ�У���ԭ�������û�ѧ����ʽ��ʾ����
���𰸡�
��1��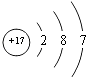
��2��N��Al��Na
��3��Al��OH��3+OH��=AlO2��+2H2O
��4��4HNO3 ![]() 4NO2��+2H2O+O2��
4NO2��+2H2O+O2��
���������⣺A��B��C��D���ֶ�����Ԫ�أ�DԪ����ɵĵ�����ͨ��״���³ʻ���ɫ������D��ClԪ�أ�A��B��C����Ԫ�ص�����������Ӧ��ˮ����ֱ�ΪX��Y��Z���ɿ�ͼת����ϵ��֪Ӧ������������ǿ�ᡢǿ��֮��ķ�Ӧ��B��C��D����Ԫ��λ��ͬһ���ڣ�Z�dz������������������CΪAl��ZΪAl��OH��3 �� BΪNa��YΪNaOH����A��D���ȣ�ԭ������֮�͵���B��C��ԭ������֮�ͣ���AΪN��XΪHNO3 �� ��1��ClԪ��ԭ�Ӻ��������Ϊ17����3�����Ӳ㣬���������Ϊ2��8��7��ԭ�ӽṹʾ��ͼΪ 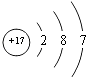 �����Դ��ǣ�
�����Դ��ǣ� 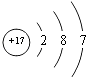 ����2��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶N��Al��Na�����Դ��ǣ�N��Al��Na����3����������������������Ӧ����ƫ��������ˮ����Ӧ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+2H2O�����Դ��ǣ�Al��OH��3+OH��=AlO2��+2H2O����4��XΪHNO3 �� ���ȶ��������ֽ⣬Ӧ��������ɫƿ�У���Ӧ�ķ���ʽΪ4HNO3
����2��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶N��Al��Na�����Դ��ǣ�N��Al��Na����3����������������������Ӧ����ƫ��������ˮ����Ӧ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+2H2O�����Դ��ǣ�Al��OH��3+OH��=AlO2��+2H2O����4��XΪHNO3 �� ���ȶ��������ֽ⣬Ӧ��������ɫƿ�У���Ӧ�ķ���ʽΪ4HNO3 ![]() 4NO2��+2H2O+O2�������Դ��ǣ�4HNO3
4NO2��+2H2O+O2�������Դ��ǣ�4HNO3 ![]() 4NO2��+2H2O+O2����
4NO2��+2H2O+O2����

 ��������ϵ�д�
��������ϵ�д�