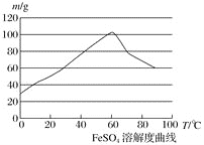
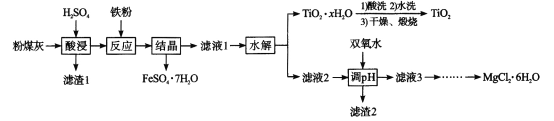
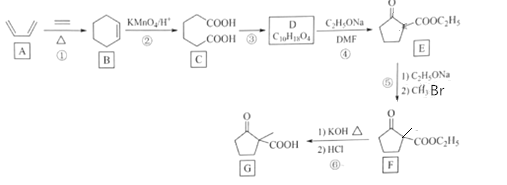
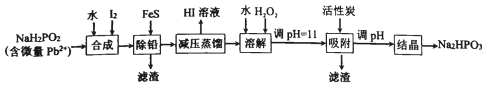
题目内容
【题目】二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。下列说法正确的是( )
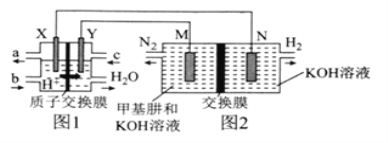
A.M极的电极反应式为CH3—NH—NH2+12OH--10e-=CO![]() +N2↑+9H2O
+N2↑+9H2O
B.图1中电解质溶液的pH减小,图2中电解质溶液的pH增大
C.图2中的交换膜是阴离子交换膜,OH-透过交换膜向N极移动
D.理论上,当生成6.72LH2时,消耗CH3OCH3的质量为2.3g
【答案】A
【解析】
装置图1分析可知,氢离子移向的电极为正极,X为负极,二甲醚失电子发生氧化反应,结合电极反应判断电极附近pH变化,Y为正极,电解质为酸性,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+3H2O-12e-=2CO2+12H+; 氧气在正极发生还原反应,O2+4H++4e-=2H2O;图2是电解池,N是阴极,H2O得电子发生还原反应:2H2O+2e-=2OH-+H2↑,M极是阳极,发生氧化反应:CH3—NH—NH2+12OH--10e-=CO![]() +N2↑+9H2O。
+N2↑+9H2O。
A.M极是阳极,发生氧化反应:CH3—NH—NH2+12OH--10e-=CO![]() +N2↑+9H2O,故A正确;
+N2↑+9H2O,故A正确;
B.图1中生成水,CH3OCH3+3O2![]() 2CO2+3H2O,电解质溶液的pH增大,图2中CH3—NH—NH2+H2O+2OH-
2CO2+3H2O,电解质溶液的pH增大,图2中CH3—NH—NH2+H2O+2OH-![]() CO
CO![]() +N2↑+5H2↑,电解质溶液的pH减小,故B错误;
+N2↑+5H2↑,电解质溶液的pH减小,故B错误;
C.图2中的交换膜是阴离子交换膜,OH-透过交换膜向M极移动,故C错误;
D.理论上,CH3OCH3~12e-~6H2,当生成标准状况下6.72LH2时,消耗CH3OCH3的质量为![]() =2.3g,但题目中没有说明生成的氢气的状态,故D错误;
=2.3g,但题目中没有说明生成的氢气的状态,故D错误;
故选A。