题目内容
【题目】在恒温恒容下使NH2COONH4 (s)![]() 2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
A.V正(NH3) =2V逆(CO2)
B.密闭容器中氨气的体积分数不变
C.密闭容器中总压强不变
D.密闭容器中混合气体的密度不变
【答案】B
【解析】
A.NH3、CO2均为生成物,V正(NH3)、V逆(CO2)反应进行的方向相反,且比值等于计量数之比,可判断达到平衡状态,A错误;
B.反应中,只有NH3、CO2为气体,且生成的量之比为2:1,反应自始至终均为2:1,则密闭容器中氨气的体积分数不变时,不能判断是否达到平衡状态,B正确;
C.若反应达到平衡时,气体的总物质的量不再改变,体积为恒容,则压强不再改变,则密闭容器中总压强不变时,达到平衡状态,C错误;
D.若反应达到平衡时,气体的总物质的量不再改变,质量也不改变,体积一直不变,ρ=m/V,则密闭容器中混合气体的密度不变时,达到平衡状态,D错误;
答案为B。

【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
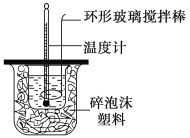
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。