��Ŀ����
��H2O2��H2SO4�Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ����֪��
Cu(s)��2H��(aq)=Cu2��(aq)��H2(g) ��H=64.39kJ��mol��1
2H2O2(l)=2H2O(l)��O2(g) ��H=��196.46kJ��mol��1
H2(g)�� O2(g)=H2O(l) ��H=��285.84kJ��mol��1
O2(g)=H2O(l) ��H=��285.84kJ��mol��1
�� H2SO4��Һ��Cu��H2O2��Ӧ����Cu2����H2O���ȷ���ʽΪ
Cu(s)��2H��(aq)=Cu2��(aq)��H2(g) ��H=64.39kJ��mol��1
2H2O2(l)=2H2O(l)��O2(g) ��H=��196.46kJ��mol��1
H2(g)��
 O2(g)=H2O(l) ��H=��285.84kJ��mol��1
O2(g)=H2O(l) ��H=��285.84kJ��mol��1 �� H2SO4��Һ��Cu��H2O2��Ӧ����Cu2����H2O���ȷ���ʽΪ
Cu(s)+H2O2(l)+2H��(aq)=Cu2��(aq)+2H2O(l) ��H=-319.68kJ.mol-1
�����˹���ɵ�Ӧ�á����ݸ�˹���ɿ�֪���٣��ڡ�2���ۼ��õ�Cu(s)+H2O2(l)+2H��(aq)=Cu2��(aq)+2H2O(l)�����Ըõķ�Ӧ�ȡ�H=64.39kJ��mol��1��196.46kJ��mol��1��2��285.84kJ��mol��1����319.68kJ.mol-1��

��ϰ��ϵ�д�
�����Ŀ
 CO+3H2���ʱ��H=_______��
CO+3H2���ʱ��H=_______��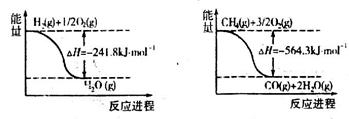
 CH3OH(g)��ͼI��ͼ���ǹ��ڸ÷�Ӧ���������ͼʾ��
CH3OH(g)��ͼI��ͼ���ǹ��ڸ÷�Ӧ���������ͼʾ��
 ������� ��
������� �� E��2��2=��3
E��2��2=��3 O2(g)��H2O(1)��H = �D285.8kJ��mol
O2(g)��H2O(1)��H = �D285.8kJ��mol
 =
=


 ��
��
 ȼ���ȵĻ�ѧ����ʽΪ��
ȼ���ȵĻ�ѧ����ʽΪ��



