题目内容
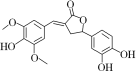
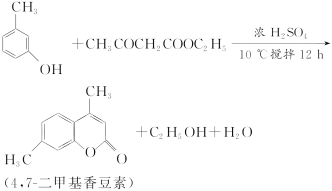
【题目】4,7二甲基香豆素(熔点:132.6 ℃)是一种重要的香料,广泛分布于植物界中,由间甲基苯酚为原料的合成反应如下:
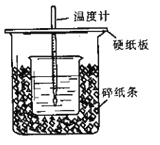
实验装置图如下:
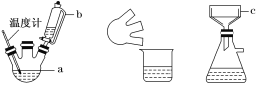
主要实验步骤:
步骤1:向装置a中加入60 mL浓硫酸,并冷却至0 ℃以下,搅拌下滴入间甲基苯酚30 mL(0.29 mol)和乙酰乙酸乙酯26.4 mL(0.21 mol)的混合物。
步骤2:保持在10 ℃下,搅拌12 h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品。
步骤3:粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0 g。
(1)简述装置b中将活塞上下部分连通的目的________________________。
(2)浓H2SO4需要冷却至0 ℃以下的原因是__________________________。
(3)反应需要搅拌12 h,其原因是_________________________________。
(4)本次实验产率为________。(百分数保留一位小数)
(5)实验室制备乙酸乙酯的化学反应方程式:_____________________________,用________(填药品名称)收集粗产品,用________(填操作名称)的方法把粗产品分离。
【答案】(1)平衡上下气压,使漏斗中液体顺利流下
(2)防止浓H2SO4将有机物氧化或炭化
(3)使反应物充分接触反应,提高反应产率 (4)90.3%
(5)CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 饱和碳酸钠溶液 分液
CH3COOCH2CH3+H2O 饱和碳酸钠溶液 分液
【解析】(1)装置b中将活塞上下部分连通的目的是平衡上下气压,使漏斗中液体顺利流下。(2)浓硫酸具有强氧化性和脱水性,因此浓H2SO4需要冷却至0 ℃以下的原因是防止浓H2SO4将有机物氧化或炭化。(3)搅拌可以使反应物充分接触反应,提高反应产率。(4)反应中间甲基苯酚是0.29 mol,乙酰乙酸乙酯是0.21 mol,所以根据方程式可知理论上应该生成0.21 mol 4,7二甲基香豆素,质量是0.21 mol×174 g·mol-1=36.54 g。实际生产中得到4,7二甲基香豆素的质量是33.0 g,所以本次实验产率为![]() ×100%=90.3%。(5)实验室制备乙酸乙酯的化学反应方程式为CH3CH2OH+CH3COOH
×100%=90.3%。(5)实验室制备乙酸乙酯的化学反应方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,用饱和碳酸钠溶液收集粗产品,由于乙酸乙酯难溶于水,所以用分液的方法把粗产品分离。
CH3COOCH2CH3+H2O,用饱和碳酸钠溶液收集粗产品,由于乙酸乙酯难溶于水,所以用分液的方法把粗产品分离。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案