题目内容
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。测定中和热的实验装置如图所示.
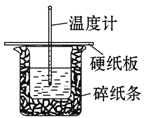
(1)大小烧杯之间填满碎泡沫塑料的作用是_________________,从实验装置上看,图中缺少的一种玻璃仪器_________________.
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。(已知:Q=m·c·Δt)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会__________(填“偏大”、“偏小”、“不受影响”).
【答案】(1)保温,减少实验过程中热量损失;环形玻璃搅拌棒;
(2)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l)ΔH=-57.3kJ·mol-1;
(3)①4;②-53.5kJ·mol-1;③ac;(4)不相等;相等;偏小。
【解析】
试题分析:(1)因为此实验需要测量温度的变化,应减少热量的损失,大小烧杯之间填满碎泡沫塑料的作用起到保温的作用,减少热量的损失,缺少玻璃唤醒搅拌棒;(2)中和热是稀酸和稀碱反应生成1mol水时放出的热量,因此反应方程式为:1/2H2SO4(aq)+ NaOH(aq) =1/2Na2SO4(aq)+ H2O(l) ΔH=-57.3 kJ·mol-1;(3)①实验次数 2与其他温度差差别大,因此省略,平均温度差为(4.0+3.9+4.1)/3=4.0;②△H=-cm△t/n(H2O)=-4.18×10-3×80×4.0/50×10-3×0.5kJ·mol-1=-53.5kJ·mol-1;③a、计算出的中和热小于57.5kJ·mol-1,说明此装置保温和隔热效果差,故正确;b、量取氢氧化钠时仰视读数,测的氢氧化钠的体积增大,放出热量多,故错误;c、多次把NaOH溶液倒入硫酸中,造成热量损失,故正确;(4)因为物质的量不同,因此放出热量是不相等,中和热跟物质的量多少无关,因此中和热不变,醋酸是弱电解质,电离是吸热过程,因此反应后温度的变化值会偏小。