题目内容
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应:N2(g)+O2(g)![]() 2NO(g) △H1=+180.5kJ·mol-1
2NO(g) △H1=+180.5kJ·mol-1
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H2。
N2(g)+2CO2(g) △H2。
已知CO的燃烧热为283.0 kJ·mol-1,则△H=_______________。
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g) ![]() N2O2(g)(快);v1正=k1正·c2(NO); v1逆=k1逆·c(N2O2) △H1<0
N2O2(g)(快);v1正=k1正·c2(NO); v1逆=k1逆·c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正·c(N2O2)c(O2);v2逆=k2逆·c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________。
②决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应_________(填“Ⅰ”或“Ⅱ”),反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是__________。
2NO2(g)速率的是反应_________(填“Ⅰ”或“Ⅱ”),反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是__________。
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(3)在一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的平均速率为_______mol·L-1·min-1,用平衡分压表示的平衡常数KP=__________(用含有P0的代数式表示)。达平衡后,若改变下列条件,既能加快反应速率又能提高NO的转化率的是____________
N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的平均速率为_______mol·L-1·min-1,用平衡分压表示的平衡常数KP=__________(用含有P0的代数式表示)。达平衡后,若改变下列条件,既能加快反应速率又能提高NO的转化率的是____________
A.增大压强 B.降低温度 C.再加入0.5molNO、0.5molCO D.分离出部分N2
【答案】-746.5kJ·mol-1 ![]() Ⅱ < C 0.05
Ⅱ < C 0.05 ![]() AC
AC
【解析】
根据盖斯定律进行计算;根据化学平衡状态和平衡常数的表达式进行解答;运用三段式,根据阿伏伽德罗定律,利用分压计算化学反应速率,根据影响化学反应速率和平衡移动的因素进行判断。
(1)根据反应:①N2(g)+O2(g)![]() 2NO(g) △H1=+180.5kJ·mol-1,②2CO(g) +O2(g)
2NO(g) △H1=+180.5kJ·mol-1,②2CO(g) +O2(g)![]() 2CO2(g)△H2=-283.0 kJ·mol-1
2CO2(g)△H2=-283.0 kJ·mol-1![]() 2=-566.0 kJ·mol-1,②-①得2NO(g)+2CO(g)
2=-566.0 kJ·mol-1,②-①得2NO(g)+2CO(g)![]() N2(g)+2CO2(g),由盖斯定律,△H=-566.0 kJ·mol-1-180.5kJ·mol-1=-746.5kJ·mol-1,故答案:-746.5kJ·mol-1;
N2(g)+2CO2(g),由盖斯定律,△H=-566.0 kJ·mol-1-180.5kJ·mol-1=-746.5kJ·mol-1,故答案:-746.5kJ·mol-1;
(2)①2NO(g)= N2O2(g) (快);②N2O2(g)+O2(g)=2NO2(g)(慢);而目标反应2NO(g) + O2(g)= 2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正![]() v2正=v1逆
v2正=v1逆![]() v2逆,即k1正·c2(NO)
v2逆,即k1正·c2(NO)![]() k2正·c(N2O2)c(O2)=k1逆·c(N2O2)
k2正·c(N2O2)c(O2)=k1逆·c(N2O2)![]() k2逆
k2逆![]() k2逆·c2(NO2),K=
k2逆·c2(NO2),K=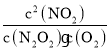 =
=![]() ,故答案:
,故答案:![]() ;
;
②由已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:Ⅰ.2NO(g)
2NO2(g)的反应历程分两步:Ⅰ.2NO(g) ![]() N2O2(g)(快);Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢),所以决定2NO(g)+O2(g)
N2O2(g)(快);Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢),所以决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应Ⅱ;因为决定2NO(g)+O2(g)= 2NO2(g)速率的是反应Ⅱ,所以反应Ⅰ的活化能E1远小于反应Ⅱ的活化能E2;决定反应速率的是反应Ⅱ,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,故C符合题意;故答案为:Ⅱ;<;C;
2NO2(g)速率的是反应Ⅱ;因为决定2NO(g)+O2(g)= 2NO2(g)速率的是反应Ⅱ,所以反应Ⅰ的活化能E1远小于反应Ⅱ的活化能E2;决定反应速率的是反应Ⅱ,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,故C符合题意;故答案为:Ⅱ;<;C;
(3)根据题干信息建立平衡三段式有:
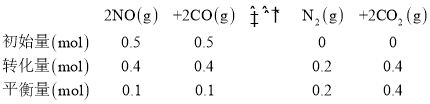
v(CO2)=![]() =0.05 mol/(L·min);因为一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,根据阿伏伽德罗定律,Kp=
=0.05 mol/(L·min);因为一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,根据阿伏伽德罗定律,Kp=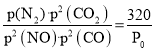 ;故答案:0.05;
;故答案:0.05;![]() ;
;
根据反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)可知:
N2(g)+2CO2(g)可知:
A.增大压强化学反应速率加快,平衡正向移动,提高NO的转化率,故A符合题意;
B.降低温度化学反应速率减慢,不符合题意,故B错误;
C.再加入0.5molNO、0.5molCO导致容器压强增大,化学反应速率加快,平衡正向移动,提高NO的转化率,故C符合题意;
D.分离出部分N2化学反应速率减慢,不符合题意,故D错误;
故答案选AC。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案