题目内容
【题目】卤族元素包括氟、氯、溴、碘、砹等元素,位于元素周期表中第ⅦA族。
(1)画出下列卤族元素的原子结构示意图:①氟________;②氯________③溴________;④碘_________。
(2)比较卤族元素的原子结构:
①它们在结构上的相同点是____________;
②它们在结构上的不同点是_____________。
(3)卤族元素原子结构的变化规律是_______________。
【答案】![]()
![]()

 最外层电子数都为7 电子层数和原子半径不同 随着核电荷数的增加,卤族元素原子的电子层数逐渐增加,原子半径逐渐增大
最外层电子数都为7 电子层数和原子半径不同 随着核电荷数的增加,卤族元素原子的电子层数逐渐增加,原子半径逐渐增大
【解析】
(1)根据原子序数,核外电子排布规律,画出原子结构示意图;
(2)根据原子结构示意图,得出结构上的相同点和不同点;
(3)卤族原子从上到下,原子结构变化规律是原子半径的递变规律;
(1)圆圈代表原子核,圈圈中的数字代表质子数,弧线代表电子层,弧线上的数字代表电子层上的电子数,根据原子序数分别为9,17,35,53,每一层最多容纳的电子数2n2,最外层电子数不超过8个,次外层电子数不超过18个,倒数第三层电子数不超过36个,根据电子总数,画出原子结构示意图:![]() 、
、![]() 、
、 、
、 ;
;
(2)①根据原子结构示意图,卤族元素结构上的相同点是最外层电子数都为7;
②根据原子结构示意图,电子层数逐渐增加,故原子半径逐渐增大,卤族元素结构上的不同点是电子层数和原子半径不同;
(3)根据原子结构示意图,卤族元素随着核电荷数(或原子序数)的增加,原子的电子层数逐渐增加,原子半径逐渐增大;

【题目】在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2O) | n(CO2) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060
【题目】以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
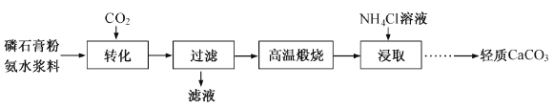
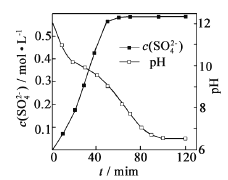
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由右图。清液pH>11时CaSO4转化的离子方程式_____________;能提高其转化速率的措施有____(填序号)
A.搅拌浆料 | B.加热浆料至100℃ |
C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。