题目内容
【题目】铬铁矿的成分主要为 FeCr2O4 ,另含有少量 Al2O3 和 SiO2 。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:
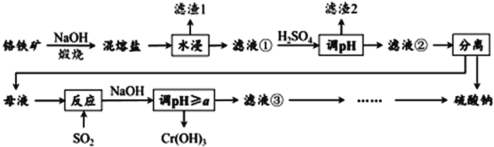
已知:铬铁矿FeCr2O4 中Cr元素在化合价为+3,“ 混熔盐 ” 中含有 Na2CrO4 和 NaFeO2 等成分,其中 NaFeO2 极易水解。试回答下列问题:
(1) “滤渣 1 ”为红褐色沉淀,其化学式为 _________________ ;
(2) 向滤液①中加 H2SO4 “调“ pH ”的目的:一是使 CrO![]() 转化为 Cr2O
转化为 Cr2O![]() ,离子方程式为 __________________ ;二是______________ 。
,离子方程式为 __________________ ;二是______________ 。
(3) “煅烧”铬铁矿时,主要成分反应的化学方程式为 _____________________ 。
(4) 根据下图溶解度(S)~温度(T) 曲线判断,

对滤液②进行的最佳“分离”方法为 ________( 填序号 ) 。
A. 蒸发结晶 B. 蒸发浓缩,趁热过滤 C. 蒸发浓缩,冷却结晶,过滤
(5) “反应”的离子方程式为 ____________________________ 。
(6) 已知 25 ℃时,Cr(OH) 3 的溶度积常数 Ksp [Cr(OH) 3 ]= 1.0 × 10 -32 。则使 Cr 3+恰好完全沉淀,即溶液中c(Cr 3+ )=1.0 × 10 -5 mol/L 时,应调节pH 的最小值a为________。
【答案】Fe(OH) 3 2CrO![]() +2H + = Cr2O
+2H + = Cr2O![]() +H2O 使 Al O
+H2O 使 Al O![]() 、 SiO
、 SiO![]() 转化为沉淀,便于过滤分离 4FeCr2O 4 +20NaOH + 7O2
转化为沉淀,便于过滤分离 4FeCr2O 4 +20NaOH + 7O2 ![]() 8Na2CrO4+ 4NaFeO2+10H2O B 3SO2 + Cr2O
8Na2CrO4+ 4NaFeO2+10H2O B 3SO2 + Cr2O![]() + 2H + ===2Cr3 ++ 3SO
+ 2H + ===2Cr3 ++ 3SO![]() + H2O 5
+ H2O 5
【解析】
FeCr2O4、Al2O3、SiO2和氢氧化钠煅烧生成Na2CrO4和NaFeO2、NaAlO2、Na2SiO3;Na2CrO4和NaFeO2、NaAlO2、Na2SiO3中加水,Na2CrO4、NaAlO2、Na2SiO3溶于水,NaFeO2水解为Fe(OH)3沉淀和氢氧化钠,过滤出Fe(OH)3沉淀,滤液中加入硫酸调节pH,使 CrO![]() 转化为Cr2O
转化为Cr2O![]() ,使 Al O
,使 Al O![]() 、SiO
、SiO![]() 转化为沉淀氢氧化铝、硅酸沉淀;根据溶解度(S)~温度(T) 曲线,蒸发浓缩,趁热过滤可分离出硫酸钠,向母液中通入SO2把Cr2O
转化为沉淀氢氧化铝、硅酸沉淀;根据溶解度(S)~温度(T) 曲线,蒸发浓缩,趁热过滤可分离出硫酸钠,向母液中通入SO2把Cr2O![]() 还原为Cr3 +,加入氢氧化钠生成Cr(OH) 3沉淀。
还原为Cr3 +,加入氢氧化钠生成Cr(OH) 3沉淀。
(1) NaFeO2水解为Fe(OH)3沉淀和氢氧化钠,所以“滤渣 1 ”为红褐色沉淀,其化学式为Fe(OH)3;
(2) 向滤液①中加H2SO4调“ pH ”的目的:一是使 CrO![]() 转化为Cr2O
转化为Cr2O![]() ,根据电荷守恒,离子方程式为2CrO
,根据电荷守恒,离子方程式为2CrO![]() +2H += Cr2O
+2H += Cr2O![]() +H2O;二是使 Al O
+H2O;二是使 Al O![]() 、SiO
、SiO![]() 转化为氢氧化铝、硅酸沉淀,便于过滤分离;
转化为氢氧化铝、硅酸沉淀,便于过滤分离;
(3) “煅烧”铬铁矿时,FeCr2O4、Al2O3、SiO2和氢氧化钠煅烧生成Na2CrO4和NaFeO2、NaAlO2、Na2SiO3,主要成分反应的化学方程式为4FeCr2O4 +20NaOH + 7O2![]() 8Na2CrO4+ 4NaFeO2+10H2O;
8Na2CrO4+ 4NaFeO2+10H2O;
(4) 根据溶解度(S)~温度(T) 曲线,在较高温度下析出硫酸钠沉淀,对滤液②分离出硫酸钠的最佳“分离”方法为蒸发浓缩,趁热过滤,选B;
(5) “反应”过程是向母液中通入SO2把Cr2O![]() 还原为Cr3 +,反应的离子方程式是3SO2 + Cr2O
还原为Cr3 +,反应的离子方程式是3SO2 + Cr2O![]() + 2H +===2Cr3 ++ 3SO
+ 2H +===2Cr3 ++ 3SO![]() + H2O;
+ H2O;
(6)使Cr 3+恰好完全沉淀,即溶液中c(Cr 3+)=1.0 × 10-5mol/L时,c(OH-)=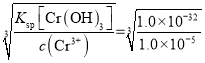 =1.0 × 10-9mol/L,应调节pH 的最小值a为5。
=1.0 × 10-9mol/L,应调节pH 的最小值a为5。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2O) | n(CO2) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060