题目内容
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN﹣、Cl﹣
B.c(H+)=10﹣12 molL﹣1的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.c(Fe2+)=1 molL﹣1的溶液中:K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
【答案】B
【解析】
A.Fe3+为有色离子,Fe3+、SCN﹣之间发生络合反应生成硫氰化铁,在溶液中不能大量共存,故A不符合题意;
B.c(H+)=10﹣12 molL﹣1的溶液中存在大量氢氧根离子,K+、Na+、CO![]() 、NO
、NO![]() 之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B符合题意;
之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B符合题意;
C.Fe2+、MnO![]() 之间发生氧化还原反应,在溶液中不能大量共存,故C不符合题意;
之间发生氧化还原反应,在溶液中不能大量共存,故C不符合题意;
D.能使甲基橙变红的溶液呈酸性,HCO![]() 与氢离子反应,在酸性溶液中不能大量共存,故D不符合题意;
与氢离子反应,在酸性溶液中不能大量共存,故D不符合题意;
故选:B。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2O) | n(CO2) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060
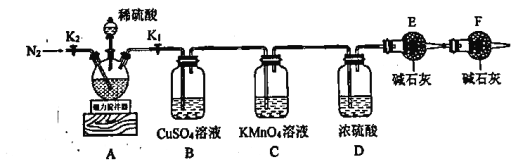
【题目】以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
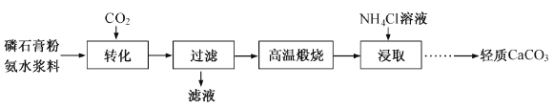
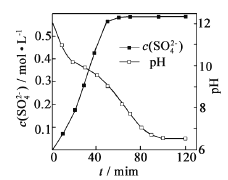
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由右图。清液pH>11时CaSO4转化的离子方程式_____________;能提高其转化速率的措施有____(填序号)
A.搅拌浆料 | B.加热浆料至100℃ |
C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。