题目内容
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
沉淀开始时pH | 2.7 | 4.1 | 8.3 |
沉淀完全时pH | 3.7 | 5.4 | 9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
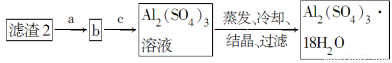
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
(1)烧杯、玻璃棒、漏斗
(2)Al+6H++3NO3—=Al3++3NO2↑+3H2O(或Al+4H++NO3—=Al3++NO↑+2H2O) Au、Pt (3)5.4≤pH<8.3
(4)加热浓缩 冷却结晶

【解析】 (1)进行过滤操作时需要用烧杯盛接滤液,用玻璃棒引流,用漏斗过滤。(2)Cu、Al、Fe、Au、Pt中加入稀硫酸和浓硝酸的混合物并加热时,Cu、Al、Fe都被氧化,硝酸浓度较高时生成NO2,硝酸浓度较低时生成NO,Au、Pt不反应,所以滤渣1为Au、Pt。(3)滤液1中含有Cu2+、Al3+、Fe3+,加入NaOH溶液调溶液pH的目的是实现Cu2+与Al3+、Fe3+的分离,当pH=5.4时,Cu2+没有沉淀,而Al3+、Fe3+沉淀完全,当pH=8.3时,Cu2+开始沉淀,所以调节溶液pH的范围为5.4≤pH<8.3。
(4)可采用加热浓缩、冷却结晶的方法将CuSO4溶液变为CuSO4·5H2O晶体。(5)滤渣2为Fe(OH)3、Al(OH)3的混合物,根据二者的性质差异将二者分离,首先向滤渣2中加入足量NaOH溶液使Al(OH)3溶解得到AlO2—,过滤除去Fe(OH)3,然后向含有AlO2—的溶液中加入适量硫酸使AlO2—转化为Al2(SO4)3,然后蒸发、冷却、结晶、过滤即可得到Al2(SO4)3·18H2O。

 习题精选系列答案
习题精选系列答案