题目内容
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;
③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是( )
A.②中由水电离出的c(H+)=1×10-12 mol/L
B.将①、③混合,若有pH=7,则消耗溶液的体积:③>①
C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L
D.将四份溶液均稀释10倍后溶液pH:③>④,②<①
D
【解析】 由于CH3COOH为弱电解质,故0.01 mol/L CH3COOH溶液中的c(H+)≠1×10-2mol/L,故由水电离出的c(H+)≠1×10-12mol/L,A项错误;因pH=12的氨水中氨水的浓度远大于0.01 mol/L,0.01 mol/L HCl与pH=12的氨水混合,当pH=7时,消耗溶液的体积:③<①,B项错误;将②、④等体积混合,溶液的总体积增大,c(CH3COO-)+c(CH3COOH)<0.01 mol/L,C项错误。0.01 mol/L HCl稀释10倍后pH=3。CH3COOH是弱酸稀释电离平衡右移,所以0.01 mol/L的CH3COOH稀释10倍后pH<3,D项正确。

由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
沉淀开始时pH | 2.7 | 4.1 | 8.3 |
沉淀完全时pH | 3.7 | 5.4 | 9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
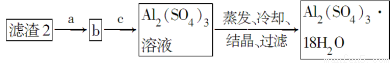
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。