题目内容
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中的悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图如下。
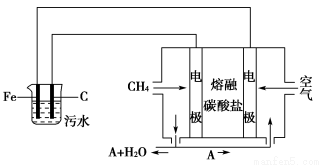
请回答下列问题。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.BaSO4 c.Na2SO4
d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是:①__________;②4OH--4e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是________________。
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4+4CO32—-8e-=5CO2+2H2O。
①正极的电极反应是____________________________________________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见装置示意图)。A物质的化学式是____________________________________________________________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________________________________________________L。
(1)c (2)Fe-2e-=Fe2+
(3)4Fe2++10H2O+O2=4Fe(OH)3↓+8H+
(4)①O2+2CO2+4e-=2CO32—(2O2+4CO2+8e-=4CO32—) ②CO2 (5)11.2
【解析】 (1)BaSO4难溶、CH3CH2OH是非电解质,显然不行;H2SO4、NaOH对溶液酸碱性影响较大,不符合“保持污水的pH在5.0~6.0之间”的要求。(3)Fe2+可以被氧气氧化,欲生成Fe(OH)3,一定要有水的参与。(4)总反应为甲烷被氧化生成CO2和H2O,减去负极反应即得正极反应式。负极产生5 mol CO2,其中4 mol CO2可被循环利用,在正极参与反应。(5)阴极产生的气体为H2,气体为44.8 L时,转移4 mol电子,消耗甲烷0.5 mol,即11.2 L。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
| Y | V |
|
|
X |
|
|
| W |
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是( )。
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2
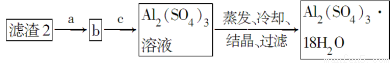
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
沉淀开始时pH | 2.7 | 4.1 | 8.3 |
沉淀完全时pH | 3.7 | 5.4 | 9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。