��Ŀ����
����Ŀ����1��������������������Ʊ�����______________________________ ��
��2����Na2CO3��10H2O��������0.10 mol/L Na2CO3��Һ480 mL��
��ʵ��ʱҪ�õ��������У���������ƽ����Ͳ���ձ�������������ͷ�ι��⣬���ٻ������õ���һ�ֲ���������___________________����ʹ�ø�����ǰ������� �IJ�����_____________,����ȡʵ����Ҳ��Ҫ�ò�����������_____________��
����������ƽ��ȡNa2CO3��10H2O���������Ϊ___________g��
��������Һʱ�����¼���������
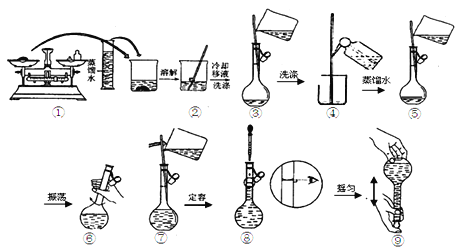
���ƹ����У����в�����������Һ��Ũ����ʲôӰ�죬�����ա�
a��Na2CO3��10H2O���岻��������NaCl
b�����������ij���������������
c������ƿ��ϴ����δ�����������ˮ
d��δ��ȴ�����¾�ת�ƶ���
e��������ˮʱ���������˿̶��ߣ������ý�ͷ�ιܽ������ˮ����
f������ʱ�����ӿ̶���
������������Һ��Ũ��ƫ�����________����Ӱ�����________������ţ���
���𰸡����ˮ����μ��뼸�α����Ȼ�����Һ��������������Һ�ʺ��ɫ 500mL����ƿ ��© ��Һ©�� 14.3 df c
��������
��1��ʵ�����Ʊ�������������ķ��������ˮ����μ��뼸�α����Ȼ�����Һ��������������Һ�ʺ��ɫ���õ������������壬��Ӧ�Ļ�ѧ����ʽΪ��FeCl3+3H2O�TFe(OH)3�����壩+3HCl��
��2������������ƿ�Ĺ��û��480mL�ģ�����Ӧ������500mL������Ҫ500mL����ƿ����ʹ������ƿǰ������м�©������ȡʵ����Ҳ��Ҫ���м�©�����Ƿ�Һ©����
����������ƽ��ȡNa2CO3��10H2O���������Ϊ0.1mol/L��0.5L��286g/mol=14.3g��
��a��Na2CO3��10H2O���岻��������NaCl�����ʵ���ƫ�٣�������ҺŨ��ƫС��b�����������������ij��������������壬��������������Ϊ13.7g��ƫ�٣�������ҺŨ��ƫС��c������ʱ��Ҫ������ˮ��������ƿ��ϴ����δ�����������ˮ����������Һ��Ũ����Ӱ�죻d��δ��ȴ�����¾�ת�ƶ��ݣ���ȴ����Һ�����С�������ӵ�ˮƫ�٣�������Һ��Ũ��ƫ��e��������ˮʱ���������˿̶��ߣ������ý�ͷ�ιܽ������ˮ������������ˮƫ�࣬������ҺŨ��ƫС��f������ʱ�����ӿ̶��ߣ�����ƫС��ˮ�������ˣ�������ҺŨ��ƫ�����ϣ�������������Һ��Ũ��ƫ�����df����Ӱ�����c��