题目内容
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下: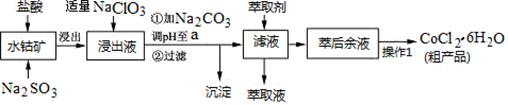
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
(1)Co2O3+SO32-+4H+=2Co2++SO42-+2H2O (2分)
(2)ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O ClO3-+5Cl-+6H+=3Cl2↑+3H2O(每空2分)
(3)Fe(OH)3 Al(OH)3 (2分)
(4)蒸发(浓缩)、冷却(结晶) (2分) 降低烘干温度,防止产品分解(1分)
(5)除去溶液中的Mn2+ B (每空1分)
(6)粗产品含有可溶性氯化物或晶体失去了部分结晶水 (1分)
解析试题分析:(1)向水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]
加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)加入NaClO3,会发生FeCl2中铁元素的化合价+2→+3,失去电子,NaClO3中氯元素的化合价由+5→-1价,得到电子,根据电荷守恒和得失电子守恒,反应为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,“浸出液”中加过量NaClO3时,有毒气体是氯气,所以推断是NaClO3和“浸出液”中的氯离子发生了氧化还原反应,ClO3-中Cl元素的化合价由+5价降低为0价,HCl中Cl元素的化合价由-1价升高到0,根据电子守恒及质量守恒定律来配平,所以其方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,离子方程式是ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;故答案为:Fe(OH)3、Al(OH)3;
(4)从溶液中制取固体的方法制取氯化钴固体,其操作步骤是蒸发浓缩、冷却结晶和过滤,根据题意知,CoCl2·6H2O常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的CoCl2·6H2O需减压烘干;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知
调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,故答案为:除去溶液中的Mn2+;选B;
(6)根据CoCl2·6H2O的组成分析,造成产品中CoCl2·6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大,结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。
考点:考查有关CoCl2·6H2O的工艺流程。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下: 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)2 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是 。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+、A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 。 ②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去 。
(3)从溶液A中回收的主要物质是 ,该物质常用作化肥。(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2,写出Mn3O4与稀硫酸反应的化学方程式 。
工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下: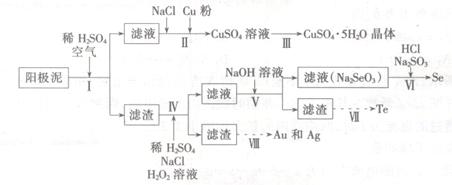
已知:①阳极泥的主要化学成分,如表1所示
表一
| 主要成份 | Cu Ag Au Se Te |
| 百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
| | 固定浸出温度 | | | 固定H2SO4浓度 |
| H2SO4浓度 mol/L | 浸出率/% | | 浸出温度/℃ | 浸出率/% |
| Cu Ag Au Se Te | | Cu Ag Au Se Te | ||
| 4 | 95.1 4.67 <0.2 0.83 8.93 | | 30 | 87.1 4.58 <0.2 0.08 6.83 |
| 3 | 94.5 4.65 <0.2 0.28 6.90 | | 40 | 94.5 4.65 <0.2 0.28 6.90 |
| 2 | 78.1 2.65 <0.2 0.05 2.85 | | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为 。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为 。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为 ;此过程中H2O2溶液的添加量要远远高于理论值,原因为 。
(5)步骤Ⅵ中所发生反应的化学方程式为 。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为 。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸 B.浓盐酸 C.浓氢氡化钠溶液 D.王水
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
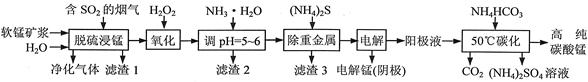
 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O




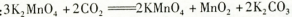

 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
