题目内容
工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下: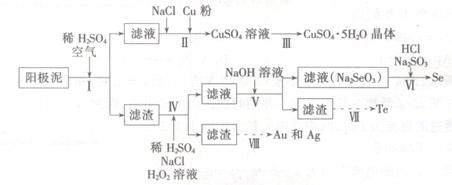
已知:①阳极泥的主要化学成分,如表1所示
表一
| 主要成份 | Cu Ag Au Se Te |
| 百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
| | 固定浸出温度 | | | 固定H2SO4浓度 |
| H2SO4浓度 mol/L | 浸出率/% | | 浸出温度/℃ | 浸出率/% |
| Cu Ag Au Se Te | | Cu Ag Au Se Te | ||
| 4 | 95.1 4.67 <0.2 0.83 8.93 | | 30 | 87.1 4.58 <0.2 0.08 6.83 |
| 3 | 94.5 4.65 <0.2 0.28 6.90 | | 40 | 94.5 4.65 <0.2 0.28 6.90 |
| 2 | 78.1 2.65 <0.2 0.05 2.85 | | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为 。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为 。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为 ;此过程中H2O2溶液的添加量要远远高于理论值,原因为 。
(5)步骤Ⅵ中所发生反应的化学方程式为 。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为 。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸 B.浓盐酸 C.浓氢氡化钠溶液 D.王水
(1)2Cu+O2+2H2SO4=2CuSO4+2H2O 硫酸浓度3 mol·L-1、浸出温度40℃
(2)除去滤液中的Ag+
(3)加热浓缩(蒸发)、冷却结晶、过滤
(4)氧化滤渣中的硒和碲,使其进入溶液中,增加硒和碲的浸出率。H2O2会有部分分解。
(5)Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O
(6)TeO32-+4e-+3H2O=Te+6OH-
(7)A
解析试题分析:(1) 步骤I的主要过程中发生的主要反应的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.由表2数据可知:硫酸的浓度越大,Cu浸出率越高。在硫酸的浓度不变时,温度越高Cu浸出率越高。但是浓度太高,杂质Se、Te的浸出率也越高;温度越高,Ag、Se、Te的浸出率也越高。综合考虑纯度、能耗等,最合适的条件是硫酸浓度3 mol/L、浸出温度40℃.(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为利用AgCl的不溶性来除去滤液中的杂质离子Ag+。(3)步骤Ⅲ从硫酸铜溶液中得到硫酸铜晶体的操作方法为加热浓缩(蒸发)、冷却结晶、过滤。(4)步骤Ⅳ中,加入H2O2溶液的作用为把滤渣中的硒和碲氧化为离子,使其进入溶液中,增加硒和碲的浸出率。此过程中H2O2溶液的添加量要远远高于理论值是因为H2O2不稳定,受热容易分解,有H2O2会有部分发生了分解反应。(5)根据过程示意图及氧化还原反应的特征与实质,可知步骤Ⅵ中所发生反应的化学方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O。(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,Te应该在阴极得到。其阴极的电极反应式为TeO32-+4e-+3H2O=Te+6OH-。(7)因为Au与常见的试剂都不能发生反应。而Ag则能与硝酸反应得到硝酸银溶液。所以步骤Ⅷ中得到的Au和Ag混合物可以用硝酸溶解,然后进行过滤分离。选项为A。
考点:考查阳极泥的综合利用的知识。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂。其化学名称为“乙酸三氯甲基苯甲酯”通常用三氯甲基苯基甲醇和醋酸酐为原料制备: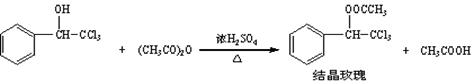
已知:
| 三氯甲基苯基甲醇 | 式量:224.5。无色液体。不溶于水,溶于乙醇。 |
| 醋酸酐 | 无色液体。溶于水形成乙酸,溶于乙醇。 |
| 结晶玫瑰 | 式量:267.5。白色至微黄色晶体。熔点:88℃。不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g。 |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇。 |

请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并 。待混合均匀后,最适宜的加热方式为 (填“水浴加热”或“油浴加热”)。
(2)粗产品的成分是结晶玫瑰与少量____________________的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在 中,按粗产品、溶剂的质量比为1: 混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | |
| ② | 将步骤1所得溶液___________ | | |
| ③ | 干燥步骤2所得白色晶体, | __________________ | 白色晶体是结晶玫瑰 |


由信息可知,从高温浓溶液中获得较大晶体的操作为 。
(4)22.45g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰22.74g,则产率是____。(保留两位有效数字)
氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:
(1)氯碱工业是利用电解食盐水生产 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是 (填下列各项中序号)。
a、碳酸钠、氢氧化钠、氯化钡 b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡 d、氯化钡、氢氧化钠、碳酸钠
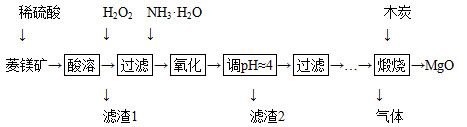
(3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
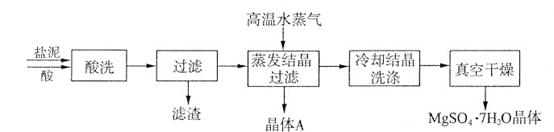
回答下列问题:
①酸洗过程中加入的酸为 ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 。
②过滤所得滤渣的主要成分为 。
③根据图分析,蒸发结晶过滤所得晶体A主要成分为 。

④真空干燥MgSO4·7H2O晶体的原因是 。
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程如下: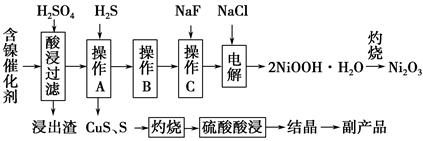

(1)根据图甲所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为________。图乙表示镍的浸出率与温度的关系,当浸出温度高于70 ℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是
________________________________________________________________。
(2)工艺流程中副产品的化学式为______________。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价:_____________________________________________
(若原方案正确,请说明理由;若原方案错误,请加以改正)。
操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3molL-1,则Ca2+的浓度为________mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为_______________________________________。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下: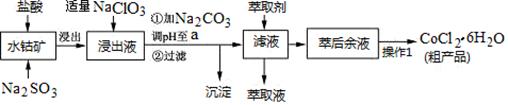
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)


 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
