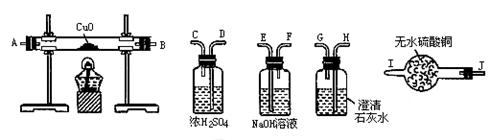
题目内容
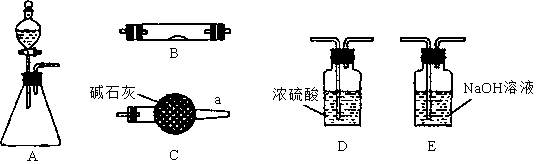
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、 。
②检查好装置的气密性后加热B前必须进行的操作是 。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
装置B中可能观察到的现象是 。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母):装置B中可能观察到的现象是 。
(1)①无水硫酸铜②氢气验纯
(2)催化剂保持红热状态;在过量氧气存在是还有红棕色气体产生
(3)淡黄色变为白色
(1)①Zn与稀硫酸反应产生的氢气,中含有H2O蒸气,因此用检验H2的氧化产物H2O来验证氢气的还原性,必需使用干燥的氢气,氢气首先通过浓硫酸进行干燥,并通过无水硫酸铜检验干燥后的气体是否还含有水蒸气;干燥后的气体通过灼热的氧化铜,然后将反应后的气体通入盛有无水硫酸铜的装置,判断水的生成。②由于氢氧混合气加热容易爆炸,因此加热前需要对氢气验纯。
(2)各装置的作用是,A装置,产生NH3和O2;C装置,干燥混合气体;B装置,NH3与O2催化氧化生成NO;C装置,吸收尾气,防止污染环境。NH3催化氧化为放热反应,因此可以看到催化剂保持红热状态;在过量氧气存在是还有红棕色气体产生。
(3)因为要检验SO2与Na2O2的反应,所以产生的SO2必需保证完全干燥,即SO2气体通过浓硫酸干燥,再通过盛有过氧化钠的装置,由于SO2污染大气,应添加尾气处理装置C,吸收SO2,但不能盛有E装置,因为E装置可能会有水蒸气与Na2O2反应。过氧化钠与SO2反应后,由淡黄色变为白色。
(2)各装置的作用是,A装置,产生NH3和O2;C装置,干燥混合气体;B装置,NH3与O2催化氧化生成NO;C装置,吸收尾气,防止污染环境。NH3催化氧化为放热反应,因此可以看到催化剂保持红热状态;在过量氧气存在是还有红棕色气体产生。
(3)因为要检验SO2与Na2O2的反应,所以产生的SO2必需保证完全干燥,即SO2气体通过浓硫酸干燥,再通过盛有过氧化钠的装置,由于SO2污染大气,应添加尾气处理装置C,吸收SO2,但不能盛有E装置,因为E装置可能会有水蒸气与Na2O2反应。过氧化钠与SO2反应后,由淡黄色变为白色。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
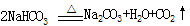 。请回答:
。请回答: 成 功
成 功 成 功
成 功
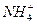 、
、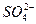 、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。
、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。
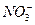 b.除去未反应的I-
b.除去未反应的I-