题目内容
【题目】下列各组微粒在指定溶液中能大量共存的是( )
A.pH=1的溶液中:CH3CH2OH、Cr2O![]() 、K+、SO
、K+、SO![]()
B.c(Ca2+)=0.1molL-1的溶液中:NH![]() 、C2O
、C2O![]() 、Cl-、Br-
、Cl-、Br-
C.加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO![]()
D.含大量HCO![]() 的溶液中:C6H5O-、CO
的溶液中:C6H5O-、CO![]() 、Br-、K+
、Br-、K+
【答案】D
【解析】
A.pH=1的溶液,显酸性,CH3CH2OH、Cr2O72-、H+之间发生氧化还原反应,不能大量共存,选项A错误;
B.Ca2+与C2O![]() 反应生成草酸钙沉淀而不能大量共存,选项B错误;
反应生成草酸钙沉淀而不能大量共存,选项B错误;
C.加入铝粉产生H2的溶液中存在大量的H+或OH-,Fe2+、H+、NO![]() 离子之间发生氧化还原反应,Fe2+与氢氧根离子反应,在溶液中一定不能大量共存,选项C错误;
离子之间发生氧化还原反应,Fe2+与氢氧根离子反应,在溶液中一定不能大量共存,选项C错误;
D.酸性:C6H5OH>HCO3-,故C6H5O-与HCO3-不反应,C6H5O-、K+、CO![]() 、Br-与HCO3-不能产生沉淀、气体、弱电解质、不发生氧化还原反应和双水解反应,故可以共存,选项D正确;
、Br-与HCO3-不能产生沉淀、气体、弱电解质、不发生氧化还原反应和双水解反应,故可以共存,选项D正确;
答案选D。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
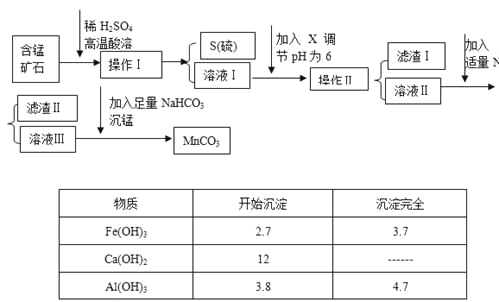
回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。