题目内容
19.某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).分析 纯水显中性,故溶液中的c(H+)=c(OH-),据此分析;若温度不变,则水的离子积不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,据此求出c(OH-)=$\frac{kw}{c({H}^{+})}$,而由水电离出的c(H+)=c(OH-);温度越高,水的电离被促进,水的离子积数值越大.
解答 解:纯水显中性,即纯水中的c(H+)=c(OH-)=2.0×10-7mol/L,此温度下,水的离子积Kw=4.0×10-14;若温度不变,则水的离子积不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中的c(OH-)=$\frac{kw}{c({H}^{+})}$=$\frac{4×1{0}^{-14}}{5.0×1{0}^{-4}}$=8×10-11mol/L,而在酸溶液中,所有的氢氧根全部来自于水的电离,而由水电离出的c(H+)=c(OH-),故由水电离出的c(H+)=8×10-11mol/L;25℃时,水的离子积Kw=1×10-14,而此温度下,水的离子积Kw=4.0×10-14,由于温度越高,水的电离被促进,水的离子积数值越大,故此温度高于25℃.
故答案为:2.0×10-7; 8×10-11;高于.
点评 本题考查了温度对水的离子积的影响和溶液中离子浓度的计算,应注意的是由水电离出的c(H+)=c(OH-),难度不大.

练习册系列答案
相关题目
9.下列关于胶体的说法不正确的是( )
| A. | 胶体和溶液一样都不带电,但是胶体中的胶体粒子可能带电 | |
| B. | 胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小不同 | |
| C. | 胶体中的微粒不能透过滤纸 | |
| D. | 用激光笔的光束照射Fe(OH)3胶体会产生丁达尔效应 |
10.环境污染已成为人类社会面临的重大威胁.下列有关环境问题的说法正确的是( )
| A. | pH在5.6~7.0之间的降水通常称作酸雨 | |
| B. | 臭氧的体积分数超过10-4%的空气有利于人体健康 | |
| C. | 燃烧煤时加入适量石灰石,可减少废气中二氧化硫含量 | |
| D. | 含磷的合成洗涤剂易于被细菌分解,故不会导致水体污染 |
7.下列说法中正确的是( )
| A. | 1mol O2和1molN2所占有的体积都约为22.4L | |
| B. | 标准状况下,22.4L由N2、N2O组成的混合气体中所含有的N的物质的量约为2mol | |
| C. | 在标准状况下,1molH2和1molH2O所占有的体积都约为22.4L | |
| D. | H2的气体摩尔体积约为22.4L |
11.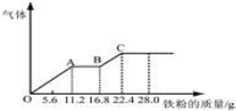 某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )
某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )
 某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )
某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )| A. | 每份溶液中NO-3物质的量为 0.4mol | |
| B. | 原溶液中H2SO4浓度为2.5mol•L-1 | |
| C. | 第一份溶液中最终溶质为CuSO4和 Cu(NO3)2 | |
| D. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═Fe2+,BC段产生氢气 |
8.某一元强酸X和某一元弱酸Y的水溶液中,c(H+)均为1×10-2mol/L,各取这两种溶液10mL分别与足量金属镁反应.下列叙述中正确的是( )
| A. | 产生H2量:X>Y | B. | 反应消耗镁的量:X>Y | ||
| C. | 反应起始时速率:X=Y | D. | 反应一段时间后速率:X>Y |