题目内容
19.下列叙述正确的是( )| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e+=Fe3+,继而形成铁锈 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的负极相连接,正极连接到一个废铁上可防止水闸被腐蚀 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
分析 A、氧化还原反应中,金属失去电子被氧化;
B、Fe作负极失电子生成Fe2+,不能到最高价离子;
C、根据电解池的工作原理:金属与电源负极相连被保护,和原电池的正极相连易被腐蚀;
D、合金的熔点都低于它的成分金属,合金的耐腐蚀性可能比其成分金属强.
解答 解:A、金属腐蚀就是金属失去电子被氧化的过程,故A错误;
B、铜板上的铁铆钉处在潮湿的空气中形成原电池,Fe作负极失电子生成Fe2+,电极反应为Fe-2e+=Fe2+,故B错误;
C、将水库中的水闸(钢板)与外加直流电源的负极相连接,作电解池的阴极,被保护,所以可防止水闸被腐蚀,故C正确;
D、合金的熔点都低于它的成分金属,合金的耐腐蚀性可能比其成分金属强,也可能比其成分金属弱,故D错误;
故选C.
点评 本题考查了金属的腐蚀与防护及合金的性质,注意掌握原电池与电解池原理,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.1g N2含有x个N2,则阿伏加德罗常数为( )
| A. | $\frac{x}{28}$ | B. | 14x mol-1 | C. | 28x mol-1 | D. | 28x |
7.下列有关物质性质的比较中不正确的是( )
| A. | 非金属性:S>Si | B. | 离子半径:Na+>S2- | ||
| C. | 第一电离能:N>O | D. | 元素电负性:C>H |
4.判断下列物质中属于电解质的是( )
| A. | 硝酸钾溶液 | B. | 硫酸钡 | C. | 金属铜 | D. | 蔗糖 |
11.下列有关反应热的说法正确的是( )
| A. | 在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量 | |
| B. | 由C(石墨,S)═C(金刚石,S)△H=+1.9kJ•mol-1,可知金刚石比石墨稳定 | |
| C. | 已知常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| D. | 已知:S(s)+O2(g)=SO2(g)△H1=-Q1 kJ•mol-1,S(g)+O2(g)=SO2(g)△H2=-Q2kJ•mol-1,则Q1<Q2 |
8.25℃、101kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3kJ•mol-1,则下列对中和热的描述正确的是( )
| A. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(1)△H=-114.6 kJ•mol-1此时中和热△H=-114.6 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(1)△H=+57.3 kJ•mol-1 | |
| C. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
9.I.对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.如表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(2)等浓度的下列溶液中由水电离出的OH-浓度由大到小的顺序是⑤③④①②(用序号作答)
①CH3COONa ②NaH2PO4 ③NaHPO4 ④NaHCO3 ⑤Na2CO3
(3)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为?,则该温度下醋酸的电离平衡常数KCH3COOH$\frac{c{a}^{2}}{1-a}$.
II.已知t℃时,Kw=1×10-13;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=9:2.
III.现有含FeCl2杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按如图所示步骤进行提纯: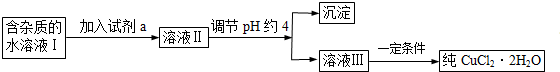
25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见如表:
请回答下列问题:
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化为Fe3+,再除去.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
利用平衡移动原理简述加入该物质的理由溶液中存在平衡Fe3++3H2O?Fe(OH)3+3H+,加入CuO或Cu(OH)2后,消耗溶液中H+,使平衡正向移动,从而使Fe3+转化为Fe(OH)3.
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).如不能,应如何操作?(若能,此空不填)应在氯化氢气氛中浓缩后冷却结晶.
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(2)等浓度的下列溶液中由水电离出的OH-浓度由大到小的顺序是⑤③④①②(用序号作答)
①CH3COONa ②NaH2PO4 ③NaHPO4 ④NaHCO3 ⑤Na2CO3
(3)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为?,则该温度下醋酸的电离平衡常数KCH3COOH$\frac{c{a}^{2}}{1-a}$.
II.已知t℃时,Kw=1×10-13;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=9:2.
III.现有含FeCl2杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按如图所示步骤进行提纯:

25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化为Fe3+,再除去.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
利用平衡移动原理简述加入该物质的理由溶液中存在平衡Fe3++3H2O?Fe(OH)3+3H+,加入CuO或Cu(OH)2后,消耗溶液中H+,使平衡正向移动,从而使Fe3+转化为Fe(OH)3.
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).如不能,应如何操作?(若能,此空不填)应在氯化氢气氛中浓缩后冷却结晶.