题目内容
18.为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如图所示方案进行实验.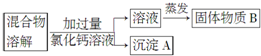
(1)沉淀A的化学式是CaCO3.
(2)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质.固体物质B的成分为NaCl、CaCl2(用化学式表示).
(3)他们继续探究后又提出了新的方案:将混合物溶解,先滴加足量稀盐酸再蒸发结晶.有关反应的离子方程式为CO32-+2H+═H2O+CO2↑.
分析 除去氯化钠样品中的杂质碳酸钠,由实验流程可知,溶于水后,加过量氯化钙发生Na2CO3+CaCl2=CaCO3↓+2NaCl,则沉淀A为CaCO3,然后过滤分离出沉淀,对滤液蒸发得到NaCl,因氯化钙过量,则B中含NaCl、CaCl2;
若将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入,因碳酸钠与盐酸反应生成氯化钠、水、二氧化碳.
解答 解:除去氯化钠样品中的杂质碳酸钠,由实验流程可知,溶于水后,加过量氯化钙发生Na2CO3+CaCl2=CaCO3↓+2NaCl,则沉淀A为CaCO3,然后过滤分离出沉淀,对滤液蒸发得到NaCl,因氯化钙过量,则B中含NaCl、CaCl2;
(1)由上述分析可知,沉淀A为CaCO3,故答案为:CaCO3;
(2)因氯化钙过量,则B中含NaCl、CaCl2,故答案为:NaCl、CaCl2;
(3)若将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入,因碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,发生的化学反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:稀盐酸;CO32-+2H+═H2O+CO2↑.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应、混合物分离提纯方法解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
8.某一元强酸X和某一元弱酸Y的水溶液中,c(H+)均为1×10-2mol/L,各取这两种溶液10mL分别与足量金属镁反应.下列叙述中正确的是( )
| A. | 产生H2量:X>Y | B. | 反应消耗镁的量:X>Y | ||
| C. | 反应起始时速率:X=Y | D. | 反应一段时间后速率:X>Y |
13.晚自习的课间,同学们站在四楼上,可以看到市里的空中有移动的光柱,这就是气溶胶发生的丁达尔效应,下列说法不正确的是( )
| A. | 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O$\frac{\underline{\;煮沸\;}}{\;}$Fe(OH)3↓+3HCl | |
| B. | 胶体分散质粒子的直径介于1~100nm之间 | |
| C. | 利用丁达尔效应可鉴别胶体和溶液 | |
| D. | 胶体和溶液都是混合物,它们属于不同的分散系 |
3.下列物质在水中电离方程式正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═$\frac{\underline{\;通电\;}}{\;}$Na++H++SO42- | ||
| C. | Ca(OH)2═Ca2++OH- | D. | Na2CO3═2Na++CO32- |
10.1g N2含有x个N2,则阿伏加德罗常数为( )
| A. | $\frac{x}{28}$ | B. | 14x mol-1 | C. | 28x mol-1 | D. | 28x |
7.下列有关物质性质的比较中不正确的是( )
| A. | 非金属性:S>Si | B. | 离子半径:Na+>S2- | ||
| C. | 第一电离能:N>O | D. | 元素电负性:C>H |
8.25℃、101kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3kJ•mol-1,则下列对中和热的描述正确的是( )
| A. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(1)△H=-114.6 kJ•mol-1此时中和热△H=-114.6 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(1)△H=+57.3 kJ•mol-1 | |
| C. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
 .
.