题目内容
7.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 0.1mol•L-1 AlC13溶液中:H+、Na+、Cl-、NO3- | |
| B. | 含有0.1mol•L-1 Fe3+的溶液中:Na+、K+、SCN-、SO42- | |
| C. | c(H+)=0.1 mol•L-1的溶液:Na+、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$、S2O${\;}_{3}^{2-}$ | |
| D. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
分析 A.离子之间不发生反应;
B.与Fe3+反应的离子不能大量共存;
C.与H+反应的离子不能大量共存;
D.由水电离产生的c(H+)=10-12 mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性.
解答 解:A.离子之间不发生反应,且与铝离子不反应,可大量共存,故A正确;
B.SCN-与Fe3+发生络合反应而不能大量共存,故B错误;
C.S2O32-与H+反应而不能大量共存,故C错误;
D.由水电离产生的c(H+)=10-12 mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存问题,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,明确信息得出溶液的酸碱性是解答本题的关键,并注意离子之间的氧化还原反应来解答,题目难度中等.

练习册系列答案
相关题目
17.设NA为阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 1molCaC2中含有阴离子数目为2NA | |
| B. | 向FeI2溶液中通入氯气,当有2molFe2+被氧化时,转移电子的数目为2NA | |
| C. | 2.8g乙烯与丙烯的混合物中含碳原子的数目为0.4NA | |
| D. | 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移电子数目为8NA |
18.下列各组性质比较中,正确的是( )
①沸点:HF>HCl>HBr>HI
②离子还原性:S2->Cl->Br->I-
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2->F->Na+>Mg2+.
①沸点:HF>HCl>HBr>HI
②离子还原性:S2->Cl->Br->I-
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2->F->Na+>Mg2+.
| A. | ①②③ | B. | ③④⑤⑥ | C. | ②③④ | D. | ①③④⑤⑥ |
15.将1L 1mol•L-1碳酸钠溶液逐滴滴入1L 1.5mol•L-1盐酸中,与将1L 1.5mol•L-1盐酸逐滴滴入1Lmol•L-1碳酸钠溶液中,相同条件下,两种操作理论上产生的气体的体积比为( )
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
2.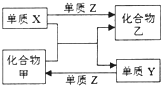 甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
 甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | X | Y | Z | 甲 | 乙 |
| A | C | H2 | O2 | H2O | CO |
| B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
| C | Mg | C | O2 | CO2 | MgO |
| D | H2 | Si | Cl2 | SiCl4 | HCl |
| A. | A | B. | B | C. | C | D. | D |
12.某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
为了鉴别上述化台物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、c为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1 mol A的溶液与含l molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+水解生成的氢氧化铝胶体能吸附水中的悬浮物净水
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为466g.
| 阳离子 | K+ Na+ Cu+ Al+ |
| 阴离子 | SO${\;}_{4}^{2-}$ HCO${\;}_{3}^{-}$ NO${\;}_{3}^{-}$ OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、c为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1 mol A的溶液与含l molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+水解生成的氢氧化铝胶体能吸附水中的悬浮物净水
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为466g.
19.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
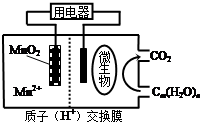

| A. | 分子组成为Cm (H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2 O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm (H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g |
16.已知N2、CO2的混合气体的质量共9.6克,标准状况下,体积为6.72L,则该混合气体中N2和CO2的体积比为( )
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
17.下列说法从化学角度分析不正确的是( )
| A. | 在一定条件下可将石墨转化为金刚石 | |
| B. | 绝大多数金属都能与硝酸反应,但不放出氢气 | |
| C. | 制取镁粉时,可将镁蒸气在氮气中冷却 | |
| D. | SO2能使品红溶液褪色,但不能使紫色石蕊溶液褪色 |