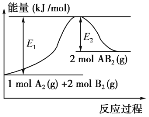
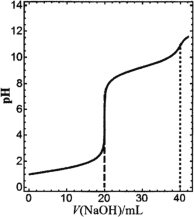
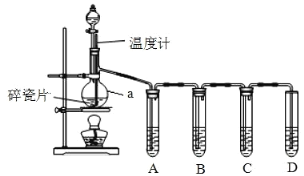
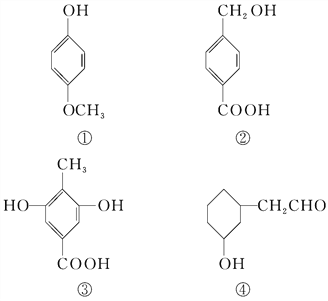
题目内容
【题目】利用分类的方法和氧化还原反应的规律,能实现某些物质的转化。
(1)请从下列试剂中选择合适的试剂完成指定转化(试剂可以重复选择)。
试剂:Cl2、HCl、Na2S、H2O;
①I2→IO3-的离子方程式:____;
②CuSO4→Na2SO4的化学方程式:_____。
(2)利用水钴矿(主要成分是Co2O3,含少量Fe2O3、Al2O3)制取CoC2O4·2H2O的流程如下:
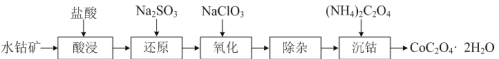
①“还原”时,Fe3+和Co3+均被还原为正二价阳离子,写出Co3+被还原的离子方程式_。
②“氧化”反应的离子方程式为:____。
【答案】I2+5Cl2+6H2O=2IO3-+10Cl-+12H+ CuSO4+Na2S=CuS↓+Na2SO4 2Co3++![]() +H2O=
+H2O=![]() +2Co2++2H+ 6Fe2++ClO
+2Co2++2H+ 6Fe2++ClO![]() +6H+=6Fe3++Cl-+3H2O
+6H+=6Fe3++Cl-+3H2O
【解析】
(1)①在氧化还原反应中,有物质化合价升高,就有化合价降低,I2中I的化合价升高,作还原剂,应选择氧化剂;
②CuSO4转化为Na2SO4,一种盐转化为另一种盐,考虑复分解反应发生的条件,生成沉淀;
(2)水钴矿加入盐酸酸浸,Fe2O3、Al2O3、Co2O3均会与HCl反应,溶液中含有Fe3+、Al3+、Co3+;加入Na2SO3,Fe3+和Co3+被还原成Fe2+、Co2+;再加入NaClO3,将Fe2+氧化成Fe3+,以便除去,最后加入(NH4)2C2O4得到产物。
(1)①在氧化还原反应中,有物质化合价升高,就有化合价降低,I2中I的化合价升高,作还原剂,应选择氧化剂,Cl2符合题意。I2中I的化合价从0价升高到+5价,生成IO3-,化合价共升高10价,Cl2中的Cl化合价从0价降低到-1价,共降低2价,化合价升降守恒,则I2和Cl2的系数比为1:5,再根据电荷守恒,物料守恒配平,离子方程式为I2+5Cl2+6H2O=2IO3-+10Cl-+12H+;
②CuSO4转化为Na2SO4,一种盐转化为另一种盐,考虑复分解反应发生的条件,生成沉淀,Na2S符合题意,化学方程式为CuSO4+Na2S=CuS↓+Na2SO4;
(2)①“还原”时,SO32-被氧化成SO42-,根据产物中Co的化合价,可知Co3+转化为Co2+,离子方程式为2Co3++SO32-+H2O=SO42-+2Co2++2H+;
②“氧化”时,Fe2+被ClO3-氧化成Fe3+,化合价升高1价;ClO3-中的Cl转化为Cl-,化合价降低6价,化合价升降守恒,则Fe2+和ClO3-的系数比为6:1,根据电荷守恒,物料守恒配平,离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O。