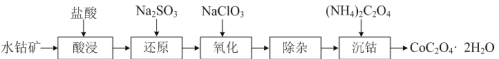
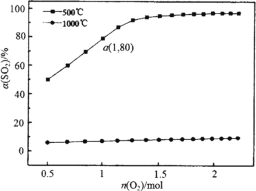
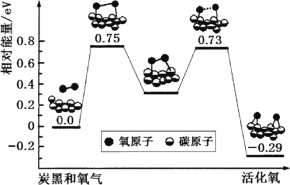
题目内容
【题目】工业上火法炼铜的过程中会发生以下反应:![]() ,下列关于该反应的说法正确的是( )
,下列关于该反应的说法正确的是( )
A.![]() 既是氧化产物又是还原产物B.每生成
既是氧化产物又是还原产物B.每生成![]() ,转移
,转移![]()
C.![]() 既是氧化剂又是还原剂D.每
既是氧化剂又是还原剂D.每![]() 硫原子被还原,则生成
硫原子被还原,则生成![]()
【答案】C
【解析】
反应![]() 中,Cu的化合价均从+1价降低为0价,则Cu2S和Cu2O
中,Cu的化合价均从+1价降低为0价,则Cu2S和Cu2O
均为氧化剂,被还原,Cu单质为还原产物,S元素的化合价从-2价升高为+4价,则Cu2S为还原剂,被氧化,SO2为氧化产物,据此解答。
A. 由以上分析知,![]() 是氧化产物,故A错误;
是氧化产物,故A错误;
B. 没有指明是标准状况,无法计算![]() 物质的量,因此不能计算转移电子数,故B错误;
物质的量,因此不能计算转移电子数,故B错误;
C. 由以上分析知,![]() 既是氧化剂又是还原剂,故C正确:
既是氧化剂又是还原剂,故C正确:
D. S元素的化合价升高,则S元素应被氧化,故D错误:
故选C。

练习册系列答案
相关题目
【题目】元素周期表中七个周期可填充的元素种类如下表所示:
周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
(1)第6、7周期均比第4、5周期多了14种元素,其原因是__。
(2)周期表中__族所含元素最多。
(3)请分析周期数与元素种类的关系,可推测出第8周期可能含有的元素种类为__(填序号)。
A.18 B.32 C.50 D.64