题目内容
有机物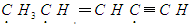 中标有“·”的碳原子的杂化方式依次为
中标有“·”的碳原子的杂化方式依次为
| A.sp、sp2、sp3 | B.sp3、sp2、sp | C.sp2、sp、sp3 | D.sp3、sp、sp2 |
B
解析试题分析:有机物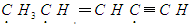 中标有“·”的碳原子的杂化方式依次为sp3、sp2、sp,故选项是B。
中标有“·”的碳原子的杂化方式依次为sp3、sp2、sp,故选项是B。
考点:考查有机物中C原子的杂化方式的知识。

练习册系列答案
相关题目
下列说法正确的是( )
| A.含有共价键的化合物一定是共价化合物 |
| B.分子中只有共价键的化合物一定是共价化合物 |
| C.离子键就是阴、阳离子间相互吸引 |
| D.只有非金属原子间才能形成共价键 |
下列说法正确的是( )
| A.CHCl3是正四面体形 |
| B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形 |
| C.二氧化碳中碳原子为sp杂化,为直线形分子 |
D.NH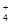 是三角锥形 是三角锥形 |
实验测得BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,以下判断正确的是( )
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.BeCl2中Be采取sp2杂化 |
下列物质中既含有共价键又含有离子键的是
| A.HF | B.NaCl | C.HCl | D.K2SO4 |
对于MgCl2中的化学键判断正确的是
| A.只有共价键 | B.既有金属键又有共价键 |
| C.只有离子键 | D.既有离子键又有共价键 |
下列有关作用力的说法正确的是
| A.金属键、离子键、分子间作用力都没有方向性和饱和性 |
| B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱 |
| C.离子键、金属键、氢键、范德华力本质上都是静电作用 |
| D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CCl4和KCl | C.NaCl和HCl | D.CO2和H2O |