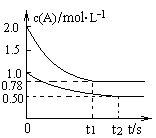题目内容
恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应: 3A(g) 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
| A.若x=2,则p>0.5a | B.若x=3,则p<0.7a |
| C.若x=4,则p= a | D.若x= 5,则p≥a |
BC
解析试题分析:假设反应开始时加入的A是物质的量为1mol.
3A(g) 2B(g)+xC(g)。
2B(g)+xC(g)。
开始(mol) 1 0 0
变化(mol) a% 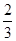 a%
a% 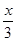 a%
a%
平衡(mol) 1-a% 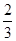 a%
a% 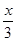 a%。
a%。
则(1-a% )+ 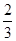 a%+
a%+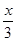 a%-1= p%。整理可得a(x-1)=3p。若x="2," p =a/3,A错误;若x="3," p ="2/3a" ;B正确;若x="4," p =a,C正确;若x= 5,则p="4" a /3>a.D错误。.
a%-1= p%。整理可得a(x-1)=3p。若x="2," p =a/3,A错误;若x="3," p ="2/3a" ;B正确;若x="4," p =a,C正确;若x= 5,则p="4" a /3>a.D错误。.
考点:考查反应前后气体体积不等的可逆反应中压强增大与物质的平衡转化率的关系的知识。

 阅读快车系列答案
阅读快车系列答案COCl2(g) CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
α1和α2分别为A在甲、乙两个恒容容器中平衡体系A(g) 2B(g)和2A(g)
2B(g)和2A(g) C(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
C(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
| A.α1、α2均减小 | B.α1、α2均增大 |
| C.α1减小,α2增大 | D.α1增大,α2减小 |
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| C.达到化学平衡时,反应则停止进行 |
| D.当反应达到平衡时,每有3mol的H—H断裂,同时就有6mol的N—H键断裂。 |
由丙烯合成正丁醛的反应:CH3CH=CH2(g)+CO+H2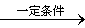 CH3CH2CH2CHO(l)
CH3CH2CH2CHO(l)
该反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是( )
| A.低温、高压、催化剂 |
| B.适当的温度、高压、催化剂 |
| C.常温、常压、催化剂 |
| D.适当的温度、常压、催化剂 |
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是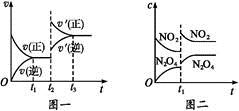
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件一定是增大了反应物的浓度 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
下列叙述不正确的是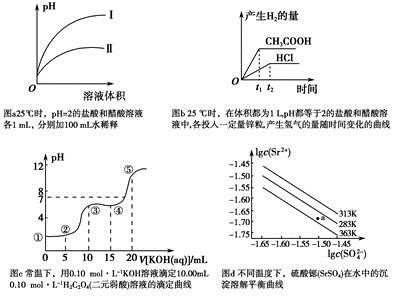
| A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像 |
| B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g |
| C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同 |
| D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液 |
恒温下,反应aX(g)  bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
| A.a>b+c | B.a<b+c |
| C.a=b+c | D.a=b=c |
 xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是