题目内容
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO,MgSO4(s) + CO(g)  MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
A
解析由题知,升高温度,平衡向正方向,气体气体的质量增大,所以密度增大,A正确;通入CO平衡虽然向正向移动,但CO的转化率比没有增加CO前要小,CO2与CO比值减小了,C错;K只与温度有关,通入SO2与K的大小无关,C错;增加固体的量,对平衡没有影响,D错。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.混合气体的平均相对分子质量 |
已知4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是 ( )
| A.4/5v(NH3)=v(O2) | B.5/6v(O2)=v(H2O) | C.2/3v(NH3)=v(H2O) | D.4/5v(O2)=v(NO) |
向某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是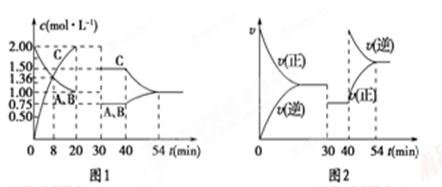
| A.30 min时改变的条件是降低温度,40 min时改变的条件是升高温度 |
| B.8 min前A的平均反应速率为0.08 mol/(L·min) |
| C.反应的化学方程式中的x=1,且正反应为吸热反应 |
| D.20 min后该反应的平衡常数均为4 |
已知反应①CO(g)+CuO(s)  CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
| A.反应①的平衡常数 |
B.反应③的平衡常K=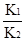 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值 |
| D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小 |
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| C.达到化学平衡时,反应则停止进行 |
| D.当反应达到平衡时,每有3mol的H—H断裂,同时就有6mol的N—H键断裂。 |
使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
| A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大 |
| B.升高平衡体系的温度(保持体积不变),混合气体的密度不变 |
| C.当反应达到平衡时,N2和H2的浓度比是1∶3 |
| D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动 |
 xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是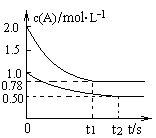
 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成了a mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为x mol、y mol、z mol(均不为0)且保持平衡时,各组分百分含量都不变。以下推断中一定正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成了a mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为x mol、y mol、z mol(均不为0)且保持平衡时,各组分百分含量都不变。以下推断中一定正确的是