题目内容
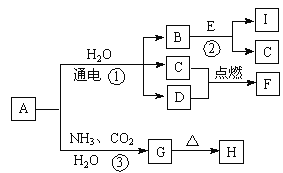
【题目】2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地煤制乙醇的过程表示如下。

(1)Cu(NO3)2是制备“催化剂X”的重要试剂。

① 气体A是_______。
② 实验室用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用_______。
③ NaClO溶液吸收气体A的离子方程式是_______。
(2)过程a包括以下3个主要反应:
Ⅰ.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1
C2H5OH(g)+CH3OH(g) ΔH1
Ⅱ.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5 (g)+CH3OH(g) ΔH2
CH3COOC2H5 (g)+CH3OH(g) ΔH2
Ⅲ.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) ΔH3
CH3CHO(g)+CH3OH(g) ΔH3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇选择性= ![]() )如下图所示。
)如下图所示。


① 已知:ΔH1 < 0。随温度降低,反应Ⅰ化学平衡常数的变化趋势是_______。
② 下列说法不合理的是________。
A.温度可影响反应的选择性
B.225℃~235℃,反应Ⅰ处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③ 为防止“反应Ⅲ”发生,反应温度应控制的范围是_______。
④ 在185℃下,CH3COOCH3起始物质的量为5 mol,生成乙醇的物质的量是____。
【答案】 NO Cu2+ + 2H2O Cu(OH)2 + 2H+ ,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制 Cu(NO3)2的水解 ![]() 增大 B < 205℃ 0.2 mol
增大 B < 205℃ 0.2 mol
【解析】(1)①铜与稀硝酸反应生成硝酸铜和一氧化氮,气体A为NO,故答案为:NO;
② 实验室用Cu(NO3)2固体配制溶液,常加入少量稀HNO3,Cu2+ + 2H2O Cu(OH)2 + 2H+ ,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制 Cu(NO3)2的水解,故答案为:Cu2+ + 2H2O Cu(OH)2 + 2H+ ,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制 Cu(NO3)2的水解;
③ NaClO溶液吸收气体NO,根据图示,次氯酸钠将NO氧化为硝酸根离子,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)① 反应Ⅰ的ΔH1 < 0,为放热反应,温度降低,平衡正向移动,化学平衡常数增大,故答案为:增大;
② A.根据图像,温度小于185℃时,随温度升高,乙醇的选择性降低,乙酸乙酯的选择性增大,温度高于185℃时,随温度升高,乙醇的选择性增大,乙酸乙酯的选择性降低,温度影响反应的选择性,故A正确;B.225℃~235℃,乙醇和乙酸乙酯的选择性相同,但不表示反应Ⅰ处于平衡状态,故B错误;C.根据反应I,增大H2的浓度,平衡正向移动,CH3COOCH3的转化率提高,故C正确;故选B;
③ 根据图2,温度超过205℃时,乙醇的选择性变化不大,但乙酸乙酯的选择性较大,如果温度升高,乙酸乙酯的选择性大幅度减小,不利于反应生成乙醇,为防止“反应Ⅲ”发生,应控制温度低于205℃,故答案为:< 205℃;
④ 在185℃下,乙醇选择性为20%,CH3COOCH3的转化率为20%,则5 molCH3COOCH3反应生成乙醇的物质的量=5mol×20%×20%=0.2mol,故答案为:0.2 mol。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶质的质量分数 | 溶液的密度/gcm-3 | |
硫酸 | c1 | w1 | ρ1 |
氨水 | c2 | w2 | ρ2 |

(1)表中硫酸的质量分数w1为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_______mol·L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____ρ2 gcm-3。
(4)标况下700体积的氨气溶解于1体积水中形成氨水饱和溶液,溶液的密度为d g/cm3,则该溶液的物质的量浓度为________(用含有d的表达式表示)。