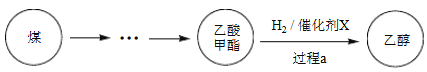
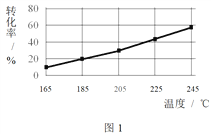
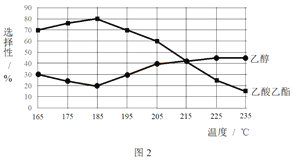
题目内容
【题目】下列物质中所含的化学键只有离子键的是
A. KCl B. NaOH C. HCl D. SO3
【答案】A
【解析】
A、K为活泼金属元素,Cl为活泼非金属元素,K和Cl之间形成的化学键是离子键,故A正确;B、NaOH中钠离子和氢氧根离子之间存在离子键,氢氧根离子中O与H之间存在共价键,故B错误;C、HCl是由H和Cl两种非金属元素通过共用电子对结合形成的,因此HCl只含有共价键,故C错误;D、SO3是由S和O两种非金属元素通过共用电子对结合形成的,因此SO3只含有共价键,故D错误;故选A。

【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。请回答下列问题:
科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的有效途径之一便是实现燃料和燃烧产物之间的良性循环(如图甲所示):
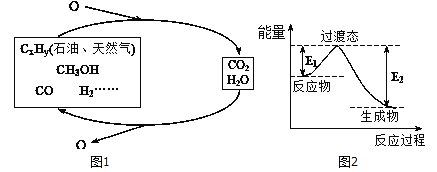
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2,转化为甲醇蒸汽和水蒸气。图乙是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ) 分别如下表:
C-H | C-O | C=O | H-H | H-O |
413.4 | 351 | 745 | 436 | 462.8 |
①结合上表数据,试写出生成CH3OH的热化学反应方程式:____________________。
②已知E2=189.8kJ·mol-1,则E1=_______。
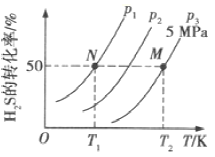
(2)将不同量的CO(g) 和H2O(g) 分别通入到体积为2L的恒容密闭容器中进行如下反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) 得到如下表所示三组数据:
CO2(g)+H2(g) 得到如下表所示三组数据:
实验 | 温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
1 | 650 | 4 | 2 | 1.6 | 6 | |
2 | 900 | 3 | 2 |
| 3 | |
3 | 900 | |||||
①该反应的△H_______0 (填“<”或“>”)。
②实验2条件下的平衡常数K=_______。
③实验3中,若起始时在容器中加入CO、H2O、CO2、H 2各1mol,则此时v正_______v逆 (填“<”“>”或“=”)。
(3)合成甲醇时所需的CO2 可以利用Na2CO3溶液从工业废气(主要含CO2) 中捕捉,其原理如图:
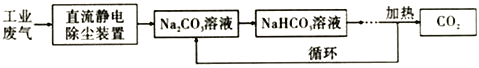
现向100mL 0.1mol/L Na2CO3溶液中通入112mL (已换算为标准状况) CO2,假设溶液中没有晶体析出,试回答下列问题:
①该工业废气处理过程中“静电除尘装置”利用了______________________________的原理。
②用离子方程式解释Na2CO3溶液呈碱性的原因:_____________________。
③反应后所得溶液中的各离子浓度由大到小的顺序是______________________________。
【题目】下列实验现象与实验结论或原理不一致的是
选项 | 实验现象 | 实验结论或原理 |
A | 生活中用泡沫灭火器灭火 | 3HCO3-+Al3+===Al(OH)3↓+3CO2↑ |
B | 向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 | 说明KSP(AgCl)>KSP(AgI) |
C | 向NaHS溶液中滴入酚酞,溶液变红色 | HS-水解程度大于电离程度 |
D | Na2CO3溶液中滴加酚酞呈红色 | CO32-+2H2O |
A. A B. B C. C D. D