题目内容
【题目】700℃时,向容积为2 L的恒容密闭容器中充入一定量的CO和H2,发生如下反应:
CO(g)+2H2(g)![]() CH3OH(g),反应过程中测定的部分数据见下表:
CH3OH(g),反应过程中测定的部分数据见下表:
反应时间/min | n(CO)/mol | n(H2)/ mol |
0 | 0.60 | 1.20 |
20 | 0.20 | |
30 | 0.40 |
下列说法正确的是
A. 反应在20 min内的平均速率为v(H2)=0.04 mol·L-1·min-1
B. 保持其他条件不变,升高温度,平衡时c(CH3OH)= 0.15 mol·L-1,则反应的ΔH<0
C. 保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,达到新平衡前v(正)> v(逆)
D. 相同温度下,若起始时向容器中充入1.0 mol CH3OH,达到平衡时CH3OH转化率大于1/3
【答案】BC
【解析】
由反应可知,30min时转化的氢气为0.8mol,则转化的CO为0.4mol,则剩余的CO为0.6mol-0.4mol=0.2mol,可知20min时达到平衡,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 0.6 1.2 0
转化 0.4 0.8 0.4
平衡 0.2 0.4 0.4
A.结合v=![]() 计算;
计算;
B.平衡时c(CH3OH)=0.2mol/L,升高温度,平衡时c(CH3OH)=0.15 molL-1,可知升高温度平衡逆向移动;
C.K=![]() =50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=
=50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=![]() =16.67<K,平衡正向移动;
=16.67<K,平衡正向移动;
D.若起始时向容器中充入1.0 mol CH3OH,设转化的甲醇为x,K=![]() =0.02,
=0.02,
CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
开始 1.0 0 0
转化 x x 2x
平衡 1-x x 2x
![]() =0.02,如x=
=0.02,如x=![]() 时,
时,![]() >0.02,则x<
>0.02,则x<![]() 时满足题意。
时满足题意。
由反应可知,30min时转化的氢气为0.8mol,则转化的CO为0.4mol,则剩余的CO为0.6mol-0.4mol=0.2mol,可知20min时达到平衡,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 0.6 1.2 0
转化 0.4 0.8 0.4
平衡 0.2 0.4 0.4
A.反应在20 min内的平均速率为v(H2)=![]() =0.02molL-1min-1,选项A错误;B.平衡时c(CH3OH)=0.2mol/L,升高温度,平衡时c(CH3OH)=0.15 molL-1,可知升高温度平衡逆向移动,则反应的△H<0,选项B正确;C.K=
=0.02molL-1min-1,选项A错误;B.平衡时c(CH3OH)=0.2mol/L,升高温度,平衡时c(CH3OH)=0.15 molL-1,可知升高温度平衡逆向移动,则反应的△H<0,选项B正确;C.K=![]() =50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=
=50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=![]() =16.67<K,平衡正向移动,则达到新平衡前v(正)>v(逆),选项C正确;D.若起始时向容器中充入1.0 mol CH3OH,设转化的甲醇为x,K=
=16.67<K,平衡正向移动,则达到新平衡前v(正)>v(逆),选项C正确;D.若起始时向容器中充入1.0 mol CH3OH,设转化的甲醇为x,K=![]() =0.02,
=0.02,
CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
开始 1.0 0 0
转化 x x 2x
平衡 1-x x 2x
![]() =0.02,如x=
=0.02,如x=![]() 时,
时,![]() >0.02,则x<
>0.02,则x<![]() 时满足题意,则达到平衡时CH3OH转化率小于
时满足题意,则达到平衡时CH3OH转化率小于![]() ,选项D错误;答案选BC。
,选项D错误;答案选BC。

【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
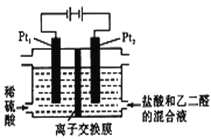
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是______________。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:_________
![]()
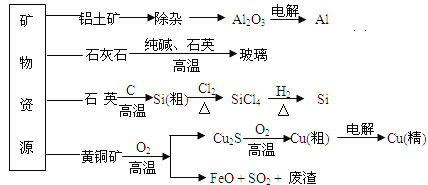
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是________________________________。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是______________________。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO_______g。
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D