题目内容
10.有A、B、C、D、E、F六种主族元素,试按下述所给的条件推断:①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,原子半径A>B>C;
②D、E、F是同主族非金属元素,它们与氢气化合可生成气态氢化物HD、HE、HF,在室温时,E的单质是液体,F的单质是固体; D是除氢外原子半径最小的元素.
(1)A的名称是钠,B、C的简单离子的氧化性强弱(用离子符号表示)Mg2+<Al3+,C的原子结构示意图是
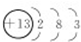 .
.(2)气态氢化物 HD、HE、HF的稳定性由强到弱是(用分子式表示)HF>HBr>HI,D、E、F离子的还原性由强到弱是(用离子符号表示)I->Br->F-.
(3)A元素与E元素形成化合物的化学式是NaBr.
(4)下列表述中能证明E的单质氧化性强于F单质的事实是b.
a.E单质的熔点小于F单质的熔点
b.E单质能将F从其可溶性盐溶液中置换出来
c.一定条件下E和F的单质都能与A的单质反应
(5)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是NaOH(填物质化学式,下同),酸性最强的是HBrO4,气态氢化物最稳定的是HF.
(6)将C的最高价氧化物对应的水化物既能与A的最高价氧化物对应的水化物中反应,也能与E的最高价氧化物对应的水化物中反应.分别写出其反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-、H++OH-=H2O.
分析 有A、B、C、D、E、F六种主族元素,①A、B、C是同一周期的金属元素,原子核外有3个电子层,原子半径A>B>C,则A为Na、B为Mg、C为Al;②D、E、F是同主族非金属元素,它们与氢气化合可生成气态氢化物HD、HE、HF,均为ⅦA族元素,E的单质为液体,则E为Br;F的单质为固体,则F为I;D是除氢气外最轻的气体且性质稳定,则D为F元素,据此解答.
解答 解:有A、B、C、D、E、F六种主族元素,①A、B、C是同一周期的金属元素,原子核外有3个电子层,原子半径A>B>C,则A为Na、B为Mg、C为Al;②D、E、F是同主族非金属元素,它们与氢气化合可生成气态氢化物HD、HE、HF,均为ⅦA族元素,E的单质为液体,则E为Br;F的单质为固体,则F为I;D是除氢气外最轻的气体且性质稳定,则D为F元素.
(1)A的名称是钠,金属性Mg>Al,故简单离子的氧化性:Mg2+<Al3+,C为Al元素,原子结构示意图是 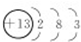 ,
,
故答案为:钠;Mg2+<Al3+;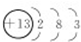 ;
;
(2)非金属性F>Br>I,故氢化物稳定性:HF>HBr>HI,非金属性越强,阴离子还原性越弱,故还原性:I->Br->F-,
故答案为:HF>HBr>HI;I->Br->F-;
(3)A元素与E元素形成化合物的化学式是NaBr,故答案为:NaBr;
(4)a.单质的熔点属于物理性质,不能比较单质氧化性强弱,故a错误;
b.溴单质能将碘从其可溶性盐溶液中置换出来,说明溴的氧化性强于碘,故b正确;
c.一定条件下溴和碘的单质都能与Na的单质反应,不能比较其氧化性强弱,可以利用与氢气反应的难易程度、剧烈程度判断,故c错误,
故选:b;
(5)在上述六种元素中,Na的金属性最强,最高价氧化物对应的水化物碱性最强的是NaOH,F元素没有最高价含氧酸,酸性最强的是HBrO4,气态氢化物最稳定的是HF,
故答案为:NaOH;HBrO4;HF;
(6)C的最高价氧化物对应的水化物为氢氧化铝,A的最高价氧化物对应的水化物为NaOH,E的最高价氧化物对应的水化物为HBrO4,氢氧化铝属于两性氢氧化物,能与强酸、强碱反应,分别与氢氧化钠、高溴酸反应离子方程式为:Al(OH)3+OH-=[Al(OH)4]-、H++OH-=H2O,
故答案为:Al(OH)3+OH-=[Al(OH)4]-、H++OH-=H2O.
点评 本题考查位置结构与性质的关系,推断元素是解题关键,注意理解掌握金属性、非金属性强弱比较的实验事实,有利于基础知识的巩固.

 优加精卷系列答案
优加精卷系列答案| A. | 煤的液化是物理变化 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 淀粉、蛋白质完全水解的产物互为同分异构体 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
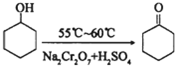
环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)从下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度;增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(60.3%).
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
| A. | Na2O | B. | H2O | C. | HCl | D. | NaOH |
| A. | CaCl2 | B. | CO2 | C. | Na2O2 | D. | CH4 |
| A. | 原子半径:A>B>C>D | |
| B. | 元素金属性:B>A,元素非金属性:D>C | |
| C. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| D. | 原子序数:b>a>c>d |
| A. | 氨气 | B. | 氯气 | C. | 二氧化硫 | D. | 氯化氢 |