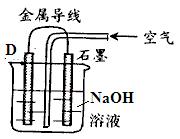
题目内容
请回答下列问题:
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有 ,用离子方程式表示X溶液呈酸性的原因是 。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体已知[n(A):n(B)=3:1],可放出l8.44 kJ热量,则该反应的热化学方程式为 。
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为 。
(5)在10L的密闭容器中,通人2molFC2气体和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为 。
(1)离子键、共价键,NH4++H2O
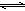 NH3·H2O+H+
NH3·H2O+H+(2)Si+2OH-+H2O=SiO32-+2H2↑。
(3)N2(g)+3H2(g)
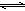 2NH3(g) ΔH=-92.2 kJ·mol-1。
2NH3(g) ΔH=-92.2 kJ·mol-1。(4)H2-2e-+2OH-=2H2O。
(5)0.90 (90%)
六种元素处于不同周期,原子序数依次增大,其中B、C同一周期,D、F同一周期,可以判断A为第一周期,B、C为第二周期,D、F为第三周期,A、D为同一主族,故A为H,D为Na,C、F为同一主族,且C原子的最外层电子数是次外层电子数的三倍,最外层电子数不能超过8个,故C的电子排布为K层2,L层6,故C为O,F为S;因此6种物质中有3中气体单质,其中已经判断出的氢、氧单质为气体,所以B、E必有一种为气体,D(Na)和F(S)之间无气体单质,故气体单质只能是处于A、C之间的B,该区间只有N形成气体,即B为N元素;E为位于D(钠)到F(S)之间的元素。
(1)A、B、C分别为H、N、O三元素;不难判断X为NH4NO3,其化学键类型为离子键、共价键;NH4NO3为强酸弱碱盐,水解显酸性。NH4++H2O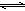 NH3·H2O+H+。
NH3·H2O+H+。
(2)由题目信息可以判断,E为Si,与碱反应的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。
(3)由题目给出的信息,可以判断,该过程为H2与N2合成铵的反应,生成1 mol NH3放出的热量为:18.44kJ/(6.8g/17g·mol-1)=46.1 kJ·mol-1,故热化学方程式为:N2(g)+3H2(g)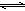 2NH3(g) ΔH=-92.2 kJ·mol-1。
2NH3(g) ΔH=-92.2 kJ·mol-1。
(4)M极通入氢气,该极为电池的负极,其电极反应为:H2-2e-+2OH-=2H2O。
(5)SO2与O2生成SO3,反应式为2SO2+O2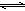 2SO3,反应过程中剩余O2为:0.21 mol×10L=2.1 mol,参加反应的氧气的物质的量为:3 mol-2.1 mol=0.9 mol;根据方程式可以得出,反应消耗的SO2为0.9 mol×2=1.8 mol,故SO2的转化率为:1.8mol/2mol="0.90" (90%)。
2SO3,反应过程中剩余O2为:0.21 mol×10L=2.1 mol,参加反应的氧气的物质的量为:3 mol-2.1 mol=0.9 mol;根据方程式可以得出,反应消耗的SO2为0.9 mol×2=1.8 mol,故SO2的转化率为:1.8mol/2mol="0.90" (90%)。
(1)A、B、C分别为H、N、O三元素;不难判断X为NH4NO3,其化学键类型为离子键、共价键;NH4NO3为强酸弱碱盐,水解显酸性。NH4++H2O
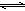 NH3·H2O+H+。
NH3·H2O+H+。(2)由题目信息可以判断,E为Si,与碱反应的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。
(3)由题目给出的信息,可以判断,该过程为H2与N2合成铵的反应,生成1 mol NH3放出的热量为:18.44kJ/(6.8g/17g·mol-1)=46.1 kJ·mol-1,故热化学方程式为:N2(g)+3H2(g)
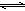 2NH3(g) ΔH=-92.2 kJ·mol-1。
2NH3(g) ΔH=-92.2 kJ·mol-1。(4)M极通入氢气,该极为电池的负极,其电极反应为:H2-2e-+2OH-=2H2O。
(5)SO2与O2生成SO3,反应式为2SO2+O2
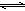 2SO3,反应过程中剩余O2为:0.21 mol×10L=2.1 mol,参加反应的氧气的物质的量为:3 mol-2.1 mol=0.9 mol;根据方程式可以得出,反应消耗的SO2为0.9 mol×2=1.8 mol,故SO2的转化率为:1.8mol/2mol="0.90" (90%)。
2SO3,反应过程中剩余O2为:0.21 mol×10L=2.1 mol,参加反应的氧气的物质的量为:3 mol-2.1 mol=0.9 mol;根据方程式可以得出,反应消耗的SO2为0.9 mol×2=1.8 mol,故SO2的转化率为:1.8mol/2mol="0.90" (90%)。
练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
 组成元素相同,含有相同的电子数
组成元素相同,含有相同的电子数 的两种粒子为同一种元素
的两种粒子为同一种元素