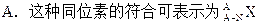题目内容
下列说法正确的是
| A.在化学反应中某元素由化合态变为游离态,该元素一定是被还原 |
| B.失电子难的原子获得电子的能力一定强 |
| C.电子层结构相同的各种离子,它的半径随核电荷数的增加而减少 |
| D.最外层电子数少的金属元素,一定比最外层电子数较它多的金属元素活泼性较强 |
C
选项A不正确。在化学反应中,若元素以阳离子或正价形式存在变为中性原子(游离态)时,是被还原了。但若元素以阴离子形式存在转变为中性原子时,则该元素却是被氧化了。例如:

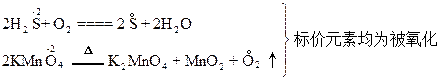
选项B不正确。失电子难的原子,在多数情况下变成离子后得电子就容易些,例如Cu比Zn难失电子,则Cu2+比Zn2+易得电子;失电子难的非金属原子,一般地说,其原子得电子就较容易些,如F比Cl难失电子,则F比Cl易得电子。但若对稀有气体来说,由于其原子的最外层已达到8个电子的稳定结构,所以它既不易得电子,也不易失去电子。故选项B未必正确。
选项C正确。“电子层结构相同”是指电子层数和各层电子数均相同,所以此时离子的半径只取决于核电荷数的多少,核电荷数越多,即核所带的正电荷越多,对核外电子的吸引力越强,所以半径越小。故选项C一定正确。
选项D未必正确。对于金属元素而言,它的活泼性强弱主要取决于元素原子失电子能力的大小,而金属原子失电子能力的大小,除了跟最外层电子数多少有关外(一般来说,最外层电子数越少,越容易失电子),还跟金属原子核外电子层结构有关,即与电子层数也有关。层数越多,一般失电子能力越强。所以D未必正确。

选项B不正确。失电子难的原子,在多数情况下变成离子后得电子就容易些,例如Cu比Zn难失电子,则Cu2+比Zn2+易得电子;失电子难的非金属原子,一般地说,其原子得电子就较容易些,如F比Cl难失电子,则F比Cl易得电子。但若对稀有气体来说,由于其原子的最外层已达到8个电子的稳定结构,所以它既不易得电子,也不易失去电子。故选项B未必正确。
选项C正确。“电子层结构相同”是指电子层数和各层电子数均相同,所以此时离子的半径只取决于核电荷数的多少,核电荷数越多,即核所带的正电荷越多,对核外电子的吸引力越强,所以半径越小。故选项C一定正确。
选项D未必正确。对于金属元素而言,它的活泼性强弱主要取决于元素原子失电子能力的大小,而金属原子失电子能力的大小,除了跟最外层电子数多少有关外(一般来说,最外层电子数越少,越容易失电子),还跟金属原子核外电子层结构有关,即与电子层数也有关。层数越多,一般失电子能力越强。所以D未必正确。

练习册系列答案
相关题目
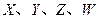 是周期表中原子序数依次增大的前20号元素。
是周期表中原子序数依次增大的前20号元素。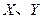 同周期。
同周期。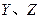 同主族,
同主族,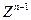 与
与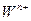 离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下
离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下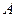 为液体,
为液体,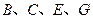 为气态化合物,且
为气态化合物,且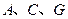 均为直线型分子;
均为直线型分子;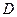 是由元素
是由元素 形成的常见化合物。
形成的常见化合物。