题目内容
 对于反应2SO2(g)+O2(g)?2SO3(g)△H<0,填写改变的条件及平衡移动的方向.
对于反应2SO2(g)+O2(g)?2SO3(g)△H<0,填写改变的条件及平衡移动的方向.t1时,
增大反应物浓度
增大反应物浓度
,平衡向正反应
正反应
移动.t2时,
降低温度
降低温度
,平衡向正反应
正反应
移动.t3时,
增大压强
增大压强
,平衡向正反应
正反应
移动.t4时,
使用催化剂
使用催化剂
,平衡不
不
移动.分析:由图可知,t1时,瞬间V正增大,V逆不变,V正>V逆,平衡向正反应移动,应是增大反应物的浓度;
t2时,瞬间V正、V逆都减小,V正减小较少、V逆减小较多,平衡向正反应移动,根据压强、温度对平衡移动的影响判断改变体积;
t3时,瞬间V正、V逆都增大,V正增大较多、V逆增大较小,平衡向正反应移动,根据压强、温度对平衡移动的影响判断改变体积;
t4时,瞬间同等程度增大V正、V逆,V正=V逆,平衡不移动,该反应前后气体的物质的量减小,故应是加入催化剂.
t2时,瞬间V正、V逆都减小,V正减小较少、V逆减小较多,平衡向正反应移动,根据压强、温度对平衡移动的影响判断改变体积;
t3时,瞬间V正、V逆都增大,V正增大较多、V逆增大较小,平衡向正反应移动,根据压强、温度对平衡移动的影响判断改变体积;
t4时,瞬间同等程度增大V正、V逆,V正=V逆,平衡不移动,该反应前后气体的物质的量减小,故应是加入催化剂.
解答:解:由图可知,
t1时,瞬间V正增大,V逆不变,V正>V逆,平衡向正反应移动,应是增大反应物的浓度;
t2时,瞬间V正、V逆都减小,V正减小较少、V逆减小较多,平衡向正反应移动,若降低压强,正反应是气体物质的量减小的反应,平衡向逆反应移动,不符合,若是降低温度,该反应正反应是放热反应,平衡向正反应移动,符合,故改变条件为降低温度;
t3时,瞬间V正、V逆都增大,V正增大较多、V逆增大较小,平衡向正反应移动,若增大压强,正反应是气体物质的量减小的反应,平衡向正反应移动,符合,若是升高温度,该反应正反应是放热反应,平衡向逆反应移动,不符合,故改变条件为增大压强;
t4时,瞬间同等程度增大V正、V逆,V正=V逆,平衡不移动,该反应前后气体的物质的量减小,故应是加入催化剂;
故答案为:增大反应物的浓度;正反应; 降低温度;正反应;增大压强;正反应;使用催化剂;不.
t1时,瞬间V正增大,V逆不变,V正>V逆,平衡向正反应移动,应是增大反应物的浓度;
t2时,瞬间V正、V逆都减小,V正减小较少、V逆减小较多,平衡向正反应移动,若降低压强,正反应是气体物质的量减小的反应,平衡向逆反应移动,不符合,若是降低温度,该反应正反应是放热反应,平衡向正反应移动,符合,故改变条件为降低温度;
t3时,瞬间V正、V逆都增大,V正增大较多、V逆增大较小,平衡向正反应移动,若增大压强,正反应是气体物质的量减小的反应,平衡向正反应移动,符合,若是升高温度,该反应正反应是放热反应,平衡向逆反应移动,不符合,故改变条件为增大压强;
t4时,瞬间同等程度增大V正、V逆,V正=V逆,平衡不移动,该反应前后气体的物质的量减小,故应是加入催化剂;
故答案为:增大反应物的浓度;正反应; 降低温度;正反应;增大压强;正反应;使用催化剂;不.
点评:本题考查化学平衡的影响因素、化学平衡速率-时间图象等,难度不大,注意把握改变条件的瞬间速率的变化特点,速率与平衡移动的关系.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
对于反应2SO2(g)+O2(g)?2SO3(g)△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图象不相符的是( )
(0~t1:v(正)=v(逆);t1时改变条件,t2时重新建立平衡)
(0~t1:v(正)=v(逆);t1时改变条件,t2时重新建立平衡)
A、 增加氧气的浓度 | B、 增大压强 | C、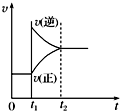 升高温度 | D、 加入催化剂 |
下列有关说法正确的是( )
| A、准确称取0.4000g NaOH固体可配成100mL 0.1000mol?L-1的NaOH标准溶液 | B、催化剂可以加快化学反应速率但不能改变化学反应的焓变 | C、100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | D、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |