题目内容
对于反应2SO2(g)+O2(g)?2SO3(g),能增大正反应速率的措施是( )
分析:升高温度、加压、增大浓度等,则增大正反应速率,结合该反应为气体体积减小的反应、放热反应来解答.
解答:解:A.移去部分SO3,正反应向移动,但正反应速率逐渐减小,故A不选;
B.增大容器的体积,相当于减压,则反应速率减小,故B不选;
C.通入大量O2,反应物浓度增大,正反应速率增大,故C选;
D.升高温度,正逆反应速率均增大,故D选;
故选CD.
B.增大容器的体积,相当于减压,则反应速率减小,故B不选;
C.通入大量O2,反应物浓度增大,正反应速率增大,故C选;
D.升高温度,正逆反应速率均增大,故D选;
故选CD.
点评:本题考查影响化学反应速率的因素,注意浓度、温度、压强对反应速率的影响即可解答,注重基础知识的考查,选项A为易错点,明确平衡正向移动正反应速率不一定增大,正确区分外界因素对平衡移动与反应速率的影响,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对于反应2SO2(g)+O2(g)?2SO3(g)△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图象不相符的是( )
(0~t1:v(正)=v(逆);t1时改变条件,t2时重新建立平衡)
(0~t1:v(正)=v(逆);t1时改变条件,t2时重新建立平衡)
A、 增加氧气的浓度 | B、 增大压强 | C、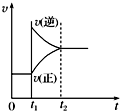 升高温度 | D、 加入催化剂 |
下列有关说法正确的是( )
| A、准确称取0.4000g NaOH固体可配成100mL 0.1000mol?L-1的NaOH标准溶液 | B、催化剂可以加快化学反应速率但不能改变化学反应的焓变 | C、100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | D、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |