题目内容
下列有关说法正确的是( )
| A、准确称取0.4000g NaOH固体可配成100mL 0.1000mol?L-1的NaOH标准溶液 | B、催化剂可以加快化学反应速率但不能改变化学反应的焓变 | C、100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | D、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
分析:A、氢氧化钠固体易潮解,氢氧化钠溶液容易与空气中的二氧化碳反应,所以无法配制0.1000mol?L-1的NaOH标准溶液;
B、催化剂只能改变反应速率,对反应产物不会有影响,所以不影响反应的焓变;
C、弱电解质酸性越弱,电离程度越小,相同pH时需要的浓度越大,据此进行判断;
D、化学平衡常数只受温度影响,温度不变,化学平衡常数不变.
B、催化剂只能改变反应速率,对反应产物不会有影响,所以不影响反应的焓变;
C、弱电解质酸性越弱,电离程度越小,相同pH时需要的浓度越大,据此进行判断;
D、化学平衡常数只受温度影响,温度不变,化学平衡常数不变.
解答:解:A、氢氧化钠溶液容易与空气中的二氧化碳反应而导致变质,即使称量出0.4000g氢氧化钠固体,最后配制的溶液中,氢氧化钠的浓度也不是0.1000mol/L,故A错误;
B、化学反应中,催化剂只影响反应速率,不会改变反应物的转化率,所以不会影响化学反应的焓变,故B正确;
C、100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB的物质的量比HA的物质的量大,而电离出的氢离子却相同,说明了HB的酸性比HA的弱,故C正确;
D、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,由于温度不变,所以平衡常数K不会变化,故D错误;
故选BC.
B、化学反应中,催化剂只影响反应速率,不会改变反应物的转化率,所以不会影响化学反应的焓变,故B正确;
C、100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB的物质的量比HA的物质的量大,而电离出的氢离子却相同,说明了HB的酸性比HA的弱,故C正确;
D、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,由于温度不变,所以平衡常数K不会变化,故D错误;
故选BC.
点评:本题考查了配制一定物质的量浓度的溶液的方法、弱电解质酸性强弱判断、化学平衡影响因素等知识,题目难度中等,注意明确影响化学平衡的因素,掌握判断弱电解质酸性强弱的方法.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
 (2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
(2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )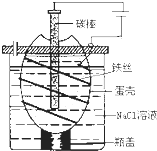 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置, (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.