题目内容
8.下列实验操作中,正确的是( )| A. | 为了使过滤速度加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 燃着的酒精灯打翻失火,应立即用水浇灭 | |
| C. | 为加速固体物质的溶解,可采用粉碎、振荡、搅拌、加热等方法 | |
| D. | 为增大气体物质的溶解度,常采用搅拌、加热等措施 |
分析 A.玻璃棒在过滤器中轻轻搅拌,易捣破滤纸;
B.酒精与水互溶,水不能灭火;
C.粉碎、振荡、搅拌、加热等均可加快溶解速率;
D.搅拌、加热均使气体的溶解度减小.
解答 解:A.玻璃棒在过滤器中轻轻搅拌,易捣破滤纸,则过滤时不能用玻璃棒搅拌,故A错误;
B.酒精与水互溶,水不能灭火,则燃着的酒精灯打翻失火,应立即用湿抹布扑灭,故B错误;
C.粉碎、振荡、搅拌、加热等均可加快溶解速率,则为加速固体物质的溶解,可采用粉碎、振荡、搅拌、加热等方法,故C正确;
D.搅拌、加热均使气体的溶解度减小,则为增大气体物质的溶解度,常采用降温等措施,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作和实验安全、影响反应速率及溶解度的因素等,把握实验技能及反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
18.按要求写出以下方程式:
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
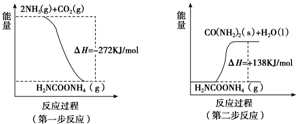
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式: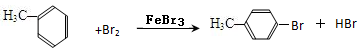 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
19.在工业生产中,硫酸不能用于( )
| A. | 制化肥 | B. | 制漂白粉 | ||
| C. | 酸洗 | D. | 医药、制炸药、农药 |
16.与0.1molH3PO4所含的氧原子数相同的是( )
| A. | 0.1molH2SO4 | B. | 0.2molH2SO3 | C. | 0.2molSO3 | D. | 0.3molCO2 |
3.铝硅合金(含Si13.5%)在凝固时收缩率很小,因而这种合金适合铸造.有下列三种物质:①铝 ②硅 ③铝硅合金,它们的熔点由低到高的顺序是( )
| A. | ①③② | B. | ②①③ | C. | ③②① | D. | ③①② |
13.有不纯的CuCl2 1.35g,与足量的AgNO3溶液反应,可生成2.9g沉淀,则该氯化铜中所含的杂质可能是下列中的( )
| A. | ZnCl2 | B. | KCl | C. | NaCl | D. | BaCl2 |
20.铜可以用来制作导线,铜的下列性质与此无关的是( )
| A. | 铜有优良的导电性 | B. | 铜在干燥的空气中不易被氧化变质 | ||
| C. | 铜较易冶炼,属常见金属 | D. | 铜的密度比较大 |
17.某元素原子核外第二层是其他层电子数之和的2倍,则该元素的核电荷数为( )
| A. | 4 | B. | 8 | C. | 12 | D. | 16 |
18.在[Fe(CN)6]3-配离子中,中心离子的配位数为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |