题目内容
3. 2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应.
2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应.(1)用A、B、O表示这类特殊晶体的化学式:ABO3.
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价.导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:$\frac{1-x}{x}$.(用含x的代数式表示)
(3)Mn的外围电子轨道表示式为:
 .
.(4)下列有关说法正确的是AD.
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如图2:
D.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强.
分析 (1)利用均摊法计算晶体晶胞中氢所各原子的个数,再根据原子数之比确定化学式;
(2)根据化合价代数和为0的原则计算;
(3)Mn的原子序数为27,根据核外电子排布规律写出核外外围电子轨道表示式;
(4)A.根据元素在周期表中的位置判断;
B.CaO为离子晶体;
C.图中堆积方式为镁型;
D.元素的电负性越强,金属性越弱.
解答 解:(1)由图1可知,晶胞中A位于顶点,晶胞中含有A为$8×\frac{1}{8}$=1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×$\frac{1}{2}$=3,则化学式为ABO3,
故答案为:ABO3;
(2)设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有 $\left\{\begin{array}{l}{3(1-x)+2x+3m+4n=6}\\{m+n=1}\end{array}\right.$,解得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为$\frac{1-x}{x}$,
故答案为:$\frac{1-x}{x}$;
(3)Mn的原子序数为27,外围电子轨道表示式为 ,故答案为:
,故答案为: ;
;
(4)A.由元素在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;
B.O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故B错误;
C.图中堆积方式为镁型,故C错误;
D.元素的电负性越强,金属性越弱,故D正确.
故答案为:AD.
点评 本题考查较为综合,主要考查了晶胞的计算、核外电子排布、第一电离能、电负性等知识点,题目难度中等,注意利用均摊法计算晶胞的构成.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
13.有不纯的CuCl2 1.35g,与足量的AgNO3溶液反应,可生成2.9g沉淀,则该氯化铜中所含的杂质可能是下列中的( )
| A. | ZnCl2 | B. | KCl | C. | NaCl | D. | BaCl2 |
11.电解CuSO4溶液时,若要达到以下三个要求:①阳极质量减少;②阴极质量增加; ③电解溶液中c(Cu2+)不变,则可选用的电极是( )
| A. | 纯铜作阳极,含Zn、Ag的Cu合金作阴极 | |
| B. | 含Zn、Ag的Cu合金作阳极,纯铜作阴极 | |
| C. | 用纯铁作阳极,纯铜作阴极 | |
| D. | 用石墨作阳极,用惰性电极(Pt)作阴极 |
18.在[Fe(CN)6]3-配离子中,中心离子的配位数为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
15.下列原子的价电子排布正确的是( )
| A. |  | B. |  | C. |  | D. |  |
13.已知奥运会吉祥物的内充物为涤纶(结构简式为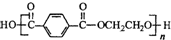 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )
 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )| A. | 羊毛的主要成分属于蛋白质 | |
| B. | 涤纶属于天然高分子化合物 | |
| C. | 合成涤纶的单体之一可以是HOCH2CH2OH | |
| D. | 可用灼烧的方法区别羊毛和涤纶 |
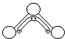 1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图所示:呈V型,键角116.5°.三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)-三个O原子均等地享有这4个电子.请回答:
1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图所示:呈V型,键角116.5°.三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)-三个O原子均等地享有这4个电子.请回答: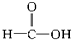 羧酸②
羧酸②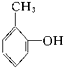 酚③
酚③ 芳香烃④
芳香烃④ 羧酸⑤
羧酸⑤ 酯.
酯.