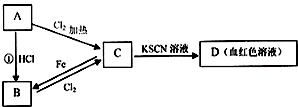
题目内容
试回答下列问题:
(1)3.01×1023个氨分子含________mol氨分子,________mol氢原子,________mol质子,________个电子.
(2)等物质的量的SO2和SO3所含的原子个数之比是________,质量比是________.
(3)0.4 mol NH3中所含氢原子数与________g水中所含氢原子数相等.
答案:
解析:
解析:
|
答案:(1)0.5 1.5 5 3.01×1024 (2)3∶4 4∶5 (3)10.8 解析:(1)n(NH3)= (2)1 mol SO2和1 mol SO3中含有的原子的物质的量分别为3 mol和4 mol,所以等物质的量的SO2和SO3所含的原子个数之比是3∶4,质量比为3 mol×64 g·mol-1∶4 mol×80 g·mol-1=4∶5. (3)0.4 mol NH3中所含氢原子的物质的量为0.4 mol×3=1.2 mol,含有1.2 mol氢原子的水的物质的量为1.2 mol÷2=0.6 mol,其质量为0.6 mol×18 g·mol-1=10.8 g. |

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目


 向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题: