题目内容
(2011?兖州市三模)下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
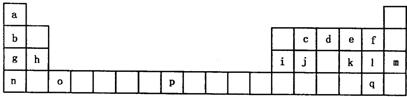
试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物中心原子的杂化方式是
(3)o元素所在族的符号是
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是
(5)f、l、q的氢化物中沸点最高的是
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点

试回答下列问题:
(1)请写出元素o的基态原子电子排布式
1s22s22p63s23p63d14s2
1s22s22p63s23p63d14s2
,g元素的价电子的四个量子数依次是3,0,0,+
(或-
)
| 1 |
| 2 |
| 1 |
| 2 |
3,0,0,+
(或-
)
.| 1 |
| 2 |
| 1 |
| 2 |
(2)d的氢化物中心原子的杂化方式是
sp3
sp3
.(3)o元素所在族的符号是
ⅢB
ⅢB
.(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是
离子键,共价键,配位键
离子键,共价键,配位键
.(5)f、l、q的氢化物中沸点最高的是
HF
HF
.(写化学式)(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点
小于
小于
jc晶体的熔点(填“大于”“等于”“小于”)原因是因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高
因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高
.分析:根据元素所在周期表中的位置可知元素的种类,根据元素对应的结构、单质及化合物的性质解答:
(1)o为Sc元素,原子序数为21,根据能量最低原理书写电子排布式,g为Na元素,价层电子为3s1,以此判断价电子的四个量子数;
(2)d为N元素,氢化物为NH3,根据价层电子对判断杂化类型;
(3)o为Sc元素,原子序数为21,位于第三周期ⅢB族;
(4)d为N元素,l为Cl元素,二者氢化物反应后的产物为NH4Cl,为含有共价键的离子化合物;
(5)f为F元素,HF中中含有氢键,沸点最高;
(6)j原子形成的晶体为Si晶体,j原子跟c原子以1:1相互交替结合而形成的jc晶体为SiC,都是原子晶体,根据共价键的键能大小比较熔点.
(1)o为Sc元素,原子序数为21,根据能量最低原理书写电子排布式,g为Na元素,价层电子为3s1,以此判断价电子的四个量子数;
(2)d为N元素,氢化物为NH3,根据价层电子对判断杂化类型;
(3)o为Sc元素,原子序数为21,位于第三周期ⅢB族;
(4)d为N元素,l为Cl元素,二者氢化物反应后的产物为NH4Cl,为含有共价键的离子化合物;
(5)f为F元素,HF中中含有氢键,沸点最高;
(6)j原子形成的晶体为Si晶体,j原子跟c原子以1:1相互交替结合而形成的jc晶体为SiC,都是原子晶体,根据共价键的键能大小比较熔点.
解答:解:(1)o为Sc元素,原子序数为21,基态原子的电子排布式为1s22s22p63s23p63d14s2,g为Na元素,价层电子为3s1,
其中n=3,l=0,m=0,ms=+
(或-
),
故答案为:1s22s22p63s23p63d14s2;3,0,0,+
(或-
);
(2)d为N元素,氢化物为NH3,分子中含有3个δ键,一个孤电子对,所以为sp3杂化,故答案为:sp3;
(3)o为Sc元素,原子序数为21,位于第三周期ⅢB族,故答案为:ⅢB;
(4)d为N元素,l为Cl元素,二者氢化物反应后的产物为NH4Cl,为含有共价键的离子化合物,并且含有配位键,
故答案为:离子键,共价键,配位键;
(5)f为F元素,HF中中含有氢键,沸点最高,故答案为:HF;
(6)j原子形成的晶体为Si晶体,j原子跟c原子以1:1相互交替结合而形成的jc晶体为SiC,都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高,
故答案为:小于;因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高.
其中n=3,l=0,m=0,ms=+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:1s22s22p63s23p63d14s2;3,0,0,+
| 1 |
| 2 |
| 1 |
| 2 |
(2)d为N元素,氢化物为NH3,分子中含有3个δ键,一个孤电子对,所以为sp3杂化,故答案为:sp3;
(3)o为Sc元素,原子序数为21,位于第三周期ⅢB族,故答案为:ⅢB;
(4)d为N元素,l为Cl元素,二者氢化物反应后的产物为NH4Cl,为含有共价键的离子化合物,并且含有配位键,
故答案为:离子键,共价键,配位键;
(5)f为F元素,HF中中含有氢键,沸点最高,故答案为:HF;
(6)j原子形成的晶体为Si晶体,j原子跟c原子以1:1相互交替结合而形成的jc晶体为SiC,都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高,
故答案为:小于;因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高.
点评:本题考查元素周期表与元素周期律的综合应用,题目难度中等,本题注意杂化轨道和晶体熔沸点的比较,易错点为配位键,注意不要漏答.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
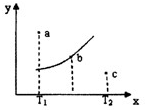 (2011?兖州市三模)有一反应:2A+B?2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
(2011?兖州市三模)有一反应:2A+B?2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )