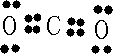题目内容
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.
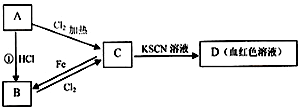
试回答下列问题:
(1)A的化学式 ,C的溶液与NaOH溶液混合后产生的现象是 .
(2)写出B溶液与Cl2反应生成C的离子方程式 .

试回答下列问题:
(1)A的化学式
(2)写出B溶液与Cl2反应生成C的离子方程式
分析:A是常见的金属,C的溶液呈现黄色,且C于KSCN溶液为血红色,结合转化关系可知,C为FeCl3,则A为Fe,B为FeCl2,然后结合化学用语及实验现象来解答.
解答:解:A是常见的金属,C的溶液呈现黄色,且C于KSCN溶液为血红色,结合转化关系可知,C为FeCl3,则A为Fe,B为FeCl2,
(1)由上述分析可知A为Fe,C为FeCl3,C的溶液与NaOH溶液反应生成红褐色氢氧化铁沉淀,观察到产生红褐色沉淀,
故答案为:Fe;产生红褐色沉淀;
(2)B溶液与Cl2反应生成C的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-.
(1)由上述分析可知A为Fe,C为FeCl3,C的溶液与NaOH溶液反应生成红褐色氢氧化铁沉淀,观察到产生红褐色沉淀,
故答案为:Fe;产生红褐色沉淀;
(2)B溶液与Cl2反应生成C的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-.
点评:本题考查无机物的推断,C为解答本题的突破口,明确铁离子的颜色及检验方法是解答本题的关键,题目难度不大.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供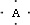 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同. +4H?→
+4H?→