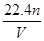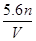题目内容
(12分)接触法制硫酸的主要原料是硫铁矿和空气。
I、接触法制硫酸的过程中,三个最主要的设备是: 、 和吸收塔;为了避免酸雾的形成,提高SO3的吸收率,工业上常用 来作吸收剂。
II、为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4 和NH4HSO4 固体混合物的组成,现称取该样品四份,分别加入浓度为3.00 mol·L-1的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
(1)由第1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)
为 L。
(2)14.48g该混合物中n((NH4)2SO4)= mol n(NH4HSO4)= mol
(3)第4组中过量的NH4+ 的物质的量为: mol
I、接触法制硫酸的过程中,三个最主要的设备是: 、 和吸收塔;为了避免酸雾的形成,提高SO3的吸收率,工业上常用 来作吸收剂。
II、为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4 和NH4HSO4 固体混合物的组成,现称取该样品四份,分别加入浓度为3.00 mol·L-1的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
为 L。
(2)14.48g该混合物中n((NH4)2SO4)= mol n(NH4HSO4)= mol
(3)第4组中过量的NH4+ 的物质的量为: mol
I、沸腾炉 接触室 98.3%的浓硫酸
II、(1)0.448 (2)0.09 (3)0.04 0.08
II、(1)0.448 (2)0.09 (3)0.04 0.08
由题给数据,第2组样品质量是第1组的2倍,产生NH3体积也是第1组的2倍;第3组样品质量是第1组的3倍,但产生NH3体积小于第1组的3倍,则NaOH溶液在第1、2组中足量,在第3组中不足。
(1)用1.81 g样品进行实验,NaOH过量,产生的NH3体积应为第1组的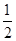 ,即生成NH3的体积为0.448 L。
,即生成NH3的体积为0.448 L。
(2)我们可以首先计算出(NH4)2SO4与NH4HSO4的物质的量之比,应根据第1组或第2组数据计算。
(NH4)2SO4~2NH3 NH4HSO4~NH3
设(NH4)2SO4物质的量为x,NH4HSO4物质的量为y,则有:
132x+115y=7.24 2x+y= 1.792/22.4
解得:x="0.02" mol y=0.04mol
n〔(NH4)2SO4〕∶n(NH4HSO4)=1∶2
进而可求出14.48g该混合物中:
n((NH4)2SO4)="0004mol" n((NH4HSO4)=0008mol
(3)由(2)知道混合物中的NH4+为0.16 mol,H+为0.08 mol
反应中依次发生反应:H++OH-=H2O
即: 0.08 0.08
NH4+ + OH- = NH3↑ + H2O
0.07 3×0.05-0.08
OH-和H+、NH4+反应后还剩余:
0.16 mol-0.07 mol ="0.09" mol
注:本小题还可以这样分析:
如果本题混合物中NH4+全部转变化NH3,相比较(1)组数据可知为0.16mol,实际得到NH3为0.07 mol,则过量的NH4+为0.09 mol
(1)用1.81 g样品进行实验,NaOH过量,产生的NH3体积应为第1组的
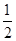 ,即生成NH3的体积为0.448 L。
,即生成NH3的体积为0.448 L。(2)我们可以首先计算出(NH4)2SO4与NH4HSO4的物质的量之比,应根据第1组或第2组数据计算。
(NH4)2SO4~2NH3 NH4HSO4~NH3
设(NH4)2SO4物质的量为x,NH4HSO4物质的量为y,则有:
132x+115y=7.24 2x+y= 1.792/22.4
解得:x="0.02" mol y=0.04mol
n〔(NH4)2SO4〕∶n(NH4HSO4)=1∶2
进而可求出14.48g该混合物中:
n((NH4)2SO4)="0004mol" n((NH4HSO4)=0008mol
(3)由(2)知道混合物中的NH4+为0.16 mol,H+为0.08 mol
反应中依次发生反应:H++OH-=H2O
即: 0.08 0.08
NH4+ + OH- = NH3↑ + H2O
0.07 3×0.05-0.08
OH-和H+、NH4+反应后还剩余:
0.16 mol-0.07 mol ="0.09" mol
注:本小题还可以这样分析:
如果本题混合物中NH4+全部转变化NH3,相比较(1)组数据可知为0.16mol,实际得到NH3为0.07 mol,则过量的NH4+为0.09 mol

练习册系列答案
相关题目