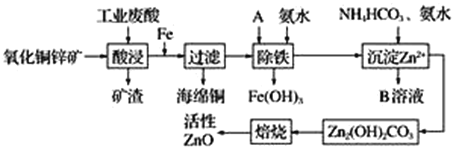
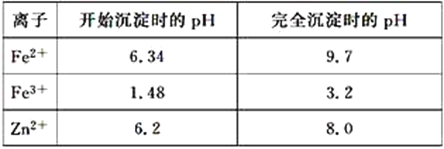
题目内容
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为____,并写出其所有可能的结构简式:________。
(2)某烃在O2中完全燃烧,生成6.6 g CO2和3.6 g H2O,在标准状态下该烃的密度为1.964 3 g·L1,则其化学式为_______。
(3)某烷烃的相对分子质量为128,该烷烃的化学式为_______。
(4)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气的混合气体在点燃完全反应后再恢复到原来的温度时,气体体积缩小了,则该烃分子内的氢原子个数___(填序号)。
A.小于4 B.大于4 C.等于4 D.无法判断
【答案】C4H10CH3—CH2—CH2—CH3、CH3—CH(CH3)—CH3C3H8C9H20A
【解析】
(1)0.1 mol烃中所含n(C)=17.6/44=0.4 mol,所含n(H)=9/18×2=1 mol,则每个烃分子中含有4个C原子、10个H原子,即该烃的化学式为C4H10。该烃属于烷烃,结构简式有两种:CH3—CH2—CH2—CH3,CH3—CH(CH3)—CH3;综上所述,本题答案是:C4H10,CH3—CH2—CH2—CH3,CH3—CH(CH3)—CH3。
(2)该烃的摩尔质量M=22.4 L· mol1×1.964 3 g·L1=44 g·mol1,即相对分子质量为44。该烃分子中N(C)∶N(H)=(6.6/44):(3.6/18×2)=3:8;该烃的最简式为C3H8,结合该烃的相对分子质量为44,可知其化学式为C3H8;综上所述,本题答案是:C3H8。
(3)设该烷烃化学式为CnH2n+2,则14n+2=128,解得n=9,则该烷烃的化学式为C9H20;综上所述,本题答案是:C9H20。
(4)设该烃的分子式为CxHy,则CxHy+(x+![]() )O2→xCO2+y/2H2O,因为反应后气体体积缩小了,则1+x+y/4>x+
)O2→xCO2+y/2H2O,因为反应后气体体积缩小了,则1+x+y/4>x+![]() ,即y<4;综上所述,本题答案是:A。
,即y<4;综上所述,本题答案是:A。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质:
)等产品。下表列出了有关物质的部分物理性质:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (d水=1g·cm-3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体,易燃、易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶; 酸性:苯甲酸>醋酸
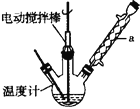
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作溶剂不参加反应)和2mL甲苯,搅拌升温至70℃ ,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。请回答下列问题:
(1)装置a的名称是 ________,主要作用是 ________;三颈瓶中发生反应的化学方程式为 ________,此反应的原子利用率理论上可达 ________(保留四位有效数字)。
(2)经测定,反应温度过高时,苯甲醛的产量有所减少,可能的原因是 ________。
(3)反应完毕后,反应混合液经过自然冷却至室温后,还应经过 ________、 ________
(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是 ________ (按步骤顺序填字母)。
a.对混合液进行分液 b.与适量碳酸氢钠溶液混合振荡
c.过滤、洗涤、干燥 d.水层中加入盐酸调节pH=2
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取1.500g产品,溶于乙醇配成100mL溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol·L-1 KOH标准溶液滴定,到达滴定终点时消耗KOH溶液20.00mL。产品中苯甲酸的质量分数为 ________ (保留四位有效数字)。
③下列情况会使测定结果偏低的是 ________ (填字母)。
A.滴定终点时仰视读取耗碱量
B.锥形瓶洗净后还留有蒸馏水
C.配置KOH标准溶液时俯视定容
D.碱式滴定管滴定前有气泡,滴定终点时气泡消失